Corynebacterium diphtheriae (коринебактерии дифтерии)
Содержание:
References
- ^ Collins, M. D. (2004). «Corynebacterium caspium sp. nov., from a Caspian seal (Phoca caspica)». International Journal of Systematic and Evolutionary Microbiology. 54 (3): 925–8. doi:. PMID .
- [page needed]
- Bernard, K.A.; Funke, G. (2012). «Genus I. Corynebacterium». In Goodfellow, M.; Kampfer, P.; Busse, H.J.; Trujillo, M.E.; Suzuki, K.; Ludwig, W.; Whitman, W.B. (eds.). Bergey’s Manual of Systematic Bacteriology (2nd ed.). Springer. p. 245.
- ^ Collins, M. D.; Cummins, C. S. (1986). «Genus Corynebacterium Lehmann and Neumann 1896, 350AL». In Sneath, P. H. A.; Mair, N. S.; Sharpe, M. E.; Holt, J. G. (eds.). Bergey’s Manual of Systematic Bacteriology. 2. Baltimore: Williams & Wilkins. pp. 1266–76.
- ^ Yassin, A. F. (2003). «Corynebacterium glaucum sp. nov». International Journal of Systematic and Evolutionary Microbiology. 53 (3): 705–9. doi:. PMID .
- Seidel, M.; Alderwick, L. J.; Sahm, H.; Besra, G. S.; Eggeling, L. (2006). «Topology and mutational analysis of the single Emb arabinofuranosyltransferase of Corynebacterium glutamicum as a model of Emb proteins of Mycobacterium tuberculosis». Glycobiology. 17 (2): 210–9. doi:. PMID .
- ^
- ^
- Pitcher, D.G. (1983). «Deoxyribonucleic acid base composition of Corynebacterium diphtheriaeand other corynebacteria with cell wall type IV». FEMS Microbiology Letters. 16 (2–3): 291–5. doi:.
- Hirsbrunner, G; Lang, J; Nicolet, J; Steiner, A (1996). «Nephrektomie nach chronischer, unilateraler, eitriger Pyelonephritis beim Rind» . Tierarztliche Praxis (in German). 24 (1): 17–21. PMID .
- Iizuka, Hideyo; Furuta, Joana Akiko; Oliveira, Edison P. Tavares de (1980). «Difteria: Situação imunitária de uma população infantil urbana de São Paulo, SP, Brasil» . Revista de Saúde Pública (in Portuguese). 14 (4): 462–8. doi:. PMID .
- ^
- at eMedicine
- Hongo, M.; Oki, T.; Ogata, S. (1972). «Phage contamination and control». In Yamada, K.; Kinoshita, S; Tsunoda, T.; Aida, K. (eds.). The Microbial Production of Amino Acids. New York: John Wiley. pp. 63–83.
- Yamada, K.; Kinoshita, S.; Tsunoda, T.; Aida, K., eds. (1972). The Microbial Production of Amino Acids. New York: Wiley.[page needed]
- Lee, Chang-Won; Lucas, Serge; Desmazeaud, Michel J. (1985). «Phenylalanine and tyrosine catabolism in some cheese coryneform bacteria». FEMS Microbiology Letters. 26 (2): 201–5. doi:.
- Kerry-Williams, S.M.; Noble, W.C. (1984). «Plasmid-associated bacteriocin production in a JK-type coryneform bacterium». FEMS Microbiology Letters. 25 (2–3): 179–82. doi:.
- Suzuki, Takeo; Honda, Haruo; Katsumata, Ryoichi (1972). «Production of Antibacterial Compounds Analogous to Chloramphenicol by a n-Paraffin-grown Bacterium». Agricultural and Biological Chemistry. 36 (12): 2223–8. doi:.
- Abe, Shigeo; Takayama, KEN-Ichiro; Kinoshita, Shukuo (1967). «Taxonomical Studies on Glutamic Acid-Producing Bacteria». The Journal of General and Applied Microbiology. 13 (3): 279–301. doi:.
- Kjeldsen, Kjeld Raunkjær (2009). Optimization of an industrial L-lysine producing Corynebacterium glutamicum strain (PhD Thesis). Technical University of Denmark. OCLC .[page needed]
- ^
- Collins, M. D.; Falsen, E.; Akervall, E.; Sjoden, B.; Alvarez, A. (1998). «Note: Corynebacterium kroppenstedtii sp. nov., a novel corynebacterium that does not contain mycolic acids». International Journal of Systematic Bacteriology. 48 (4): 1449–54. doi:. PMID .
Кто такой Мобилункус?
Мобилункус (Mobiluncus) относится к бактериям-палочкам. Это часть условно-патогенной (читай – нормальной) флоры, которая может быть безвредной, но при определенных условиях, например, ослабленном иммунитете, может вызывать заболевания.
Мобилункус обнаруживается при многих воспалительных процессов урогенитального тракта у женщин и мужчин.
У мужчин наличие мобилункуса часто ассоциировано с воспалительным процессом в уретре, у женщин он ассоциируется с патологическим состоянием влагалища – вагинозом.
У вагиноза множество альтернативных названий, среди которых аминокольпит, анаэробный вагиноз, вагинальный бактериоз, вагинальный лактобациллез, гарднереллезный вагинит (гарднереллез), гемофильный вагинит, коринебактериальный вагинит, неспецифический вагиноз,– и даже это не полный список.
Несмотря на обилие названий, все они могут означать лишь одно – воспаление, вызванное бактериальной инфекцией.
Воспалительные заболевания влагалища инфекционной природы занимают первое место среди всех гинекологических заболеваний.
Их возбудителями становятся бактерии, являющиеся частью нормальной микрофлоры влагалища.
Количество таких заболеваний с каждым годом растет, и тому есть немало причин. Среди них экологическая ситуация, бездумное применение антибактериальных средств, нарушения питания, повышенная стрессовая нагрузка и другие.
Неприятные ощущения (зуд, жжение и так далее) встречаются, но относительно редко, как и дизурический синдром.
При длительном течении заболевания выделения из влагалища становятся более густыми, тягучими и липкими, желто-зелеными, могут пениться.
Заболеванию приписывают риск осложнений при беременности (преждевременные роды, внутриутробное инфицирование плода и так далее), послеродовых осложнений воспалительного характера.
Профилактика воспалительных процессов во влагалище включает:
- отказаться от бесконтрольного использования антибиотиков и антимикробных препаратов;
- взять под контроль стресс: физический и эмоциональный;
- больше двигаться, ходить пешком, что нормализует гормональный фон;
- заниматься здоровьем не только влагалища, но и всей триады, в которую входят мочевой пузырь и кишечник.
Клиника (симптомы + жалобы) важнее результатов анализов. Если мазок выявляет наличие мобилункуса или любой другой патогенной или условно-патогенной флоры, но у вас нет жалоб, то к вопросу лечения следует подходить крайне взвешенно.
Кишечная флора вызывает заболевания, но при соблюдении гигиены наружных половых органов, здоровом питании и образе жизни риск минимален.
Corynebacterium jeikeium
Это недифтерийные коринебактерии, включают в себя 17 подвидов, на коже человека присутствуют только несколько из них. Одни виды переносятся только крупным рогатым скотом, другие же, как Corynebacteriumjeikeium (СJ) – обитатели эпителия человека. Хотя многие коринебактерии присутствуют на коже человека, с точки зрения медицины, интересны именно СJ. Они часто провоцируют инфекции у людей с ослабленным иммунитетом, повреждениями кожи и носителей искусственных органов. Кроме того, СJ считаются причиной высыпаний, похожих по гистологическим признакам на ботриомикоз. Если такая бактерия проникает через кожу, то вероятно появление сепсиса или эндокардита.
СJ отличается от остальных грамположительных бактерий тем, что может противостоять различным антибиотикам, но при этом уязвима для гликопептидов, включая ванкомицин и тейкопланин.
Как и эпидермальный стафилококк, СJ считается частью здоровой микрофлоры. Эти бактерии можно найти на теле любого человека, в области паха, подмышек и промежности. Большинство провоцируемых ими инфекций возникают у тех, кто не может похвастаться крепким здоровьем. В целом же, СJ распространены повсеместно и являются абсолютно безобидными, подтверждая тем самым гипотезу о своем мутуализме.
Исследования СJ проводились только в разрезе их потенциальных вирулентных свойств, поэтому о других их возможностях ничего не известно.
Что такое нормальная микрофлора половых органов
В процессе эволюции ряд микроорганизмов приспособился к обитанию в мочеполовых органов человека.Часть из них мирно сосуществует с организмом,размножается и даже выполняет весьма нужные функции .Такая микрофлора названа нормальной (естественной).Колонизация микроорганизмами половых органов происходит уже в первые часы после рождения ребенка.
|
Нормальная микрофлора не вызывает заболевания у человека (очень редко у больных с выраженным иммунодефицитом).В последнее время исследованиями было доказано о возникновении у некоторых женщин так называемого цитолитического вагиноза,вследствии негативного действия на эпителий влагалища лактобацилл,представителей нормальной микрофлоры. |
Cell structure and metabolism
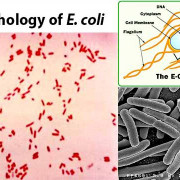
Morphology of Corynebacterium Diphtheriae
Cell Exterior
Being Gram-positive, C. diphtheriae has a cell membrane and a lipid-rich murein layer outside the membrane. Like M. tuberculosis, another Actinomycete, C. diphtheriae has an arabinogalactan polymer which anchors a lipid rich domain to the murein layer. Corynomycolic acids, alpha-alkyl beta-hydroxy fatty acids, are produced through a Claisen-like condensation reaction between two fatty acyl chains.
Also in the exterior are the fimbriae (pili). Not much structural analysis has been done, however it is very likely that sortase-like proteins are produced to aid in anchoring the fimbriae and possibly polymerizing them. C. diphtheriae has six genes which code for putative sortases — five are localized on PAIs, none of which are found in closely related non-pathogenic corynebacteria (C. glutamicum and C. efficens). The absence of these genes in the non-pathogenic relatives suggests that those genes increase the pathogenicity of C. diphtheriae through the fimbriae, most likely by aiding the bacterium invade and adhere to host cells. The similarity to the sortase-related fimbrial system of Actinomyces, and the newness of the genes in the C. diphtheria genome, suggest that these genes were newly acquired, possibly the cause of the recent upsurge in outbreaks of Diphtheria.
Metabolic processes
Pathways discovered for metabolism include the complete pentose phosphate pathway, glycolysis, and gluconeogenesis, based on the enzymes present in the cell. The citric acid cycle is present, however C. diphtheriae lacks succinyl-CoA synthetase and uses an enzyme transcribed by a homologue of the Clostridium kluyveri cat1 gene, which acts as a coenzyme A transferase rather than a synthetase. De novo amino acid biosynthesis is also present in C. diphtheriae, as well as both anaerobic and aerobic respiration pathways, though C. diphtheriae is primarily aerobic. Production of purines is complete, however of the pyrimidines, the cytidine production pathway lacks the final cytidine triphosphate synthetase, which is present in other related organisms such as C. efficens and M. tuberculosis.
Specialized Iron Intake and Diphtheria Toxin
Diphtheria toxin is the most significant molecule produced by C. diphtheriae. The tox gene which codes for the Diphtheria toxin is located on the right-handed end of an integrated corynephage. C. diptheriae contains the protein DtxR, an iron-dependent negative-regulatory protein which prevents the tox gene from being transcribed under high iron conditions, as well as the high-energy iron uptake system of the bacterium. Because a host often reacts to infection by lowering iron levels, the bacteria have developed a mechanism which couples Diphtheria toxin gene expression with low iron levels.
To import iron, C. diphtheriae has seven different systems, two of which have been identified. The siderophore system creates ferrisiderophores, molecules specialized in binding to iron and bringing it into the cell for usage.
Биохимические свойства коринебактерий
Дифтерийная палочка является аэробом или факультативным анаэробом, температурный оптимум для роста 35-37 °С (границы роста 15-40 °С), оптимальная рН 7,6-7,8. К питательным средам не очень требовательна, но лучше растет на средах, содержащих сыворотку или кровь. Избирательными для дифтерийных бактерий являются свернутые сывороточные среды Ру или Леффлера, рост на них появляется через 8-12 ч в виде выпуклых, величиной с булавочную головку колоний серовато-белого или желтовато-кремового цвета. Поверхность их гладкая или слегка зернистая, на периферии колонии несколько более прозрачные, чем в центре. Колонии не сливаются, вследствие чего культура приобретает вид шагреневой кожи. На бульоне рост проявляется в виде равномерного помутнения, либо бульон остается прозрачным, а на его поверхности образуется нежная пленка, которая постепенно утолщается, крошится и хлопьями оседает на дно.
Особенностью дифтерийных бактерий является их хороший рост на кровяных и сывороточных средах, содержащих такие концентрации теллурита калия, которые подавляют рост других видов бактерий. Это связано с тем, что С. diphtheriae восстанавливают теллурит калия до металлического теллура, который, откладываясь в микробных клетках, придает колониям характерный темно-серый или черный цвет. Применение таких сред повышает процент высеваемости дифтерийных бактерий.
Corynebacterium diphtheriae ферментируют глюкозу, мальтозу, галактозу с образованием кислоты без газа, но не ферментируют (как правило) сахарозу, имеют цистиназу, не имеют уреазы и не образуют индола. По этим признакам они отличаются от тех коринеформных бактерий (дифтероидов), которые чаще других встречаются на слизистой оболочке глаза (Corynebacterium xerosus) и носоглотки (Corynebacterium pseiidodiphtheriticum) и от других дифтероидов.
В природе существуют три основных варианта (биотипа) дифтерийной палочки: gravis, intermedins и mitis. Они различаются по морфологическим, культуральным, биохимическим и другим свойствам.
Деление дифтерийных бактерий на биотипы было произведено с учетом того, при каких формах течения дифтерии у больных они выделяются с наибольшей частотой. Тип gravis чаще выделяется от больных с тяжелой формой дифтерии и вызывает групповые вспышки. Тип mitis вызывает более легкие и спорадические случаи заболеваний, а тип intermedius занимает промежуточное положение между ними. Corynebacterium belfanti, ранее относимый к биотипу mitis, выделен в самостоятельный, четвертый, биотип. Его главное отличие от биотипов gravis и mitis — способность восстанавливать нитраты в нитриты. Штаммы Corynebacterium belfanti обладают выраженными адгезивными свойствами, и среди них обнаруживаются как токсигенные, так и нетоксигенные варианты.
[], [], [], [], [], [], [], []
Что показывает анализ на Eubacterium spp
Анализ на эубактерии считается одним из наиболее распространенных методов исследования. Благодаря этой диагностике специалист имеет возможность выявить степень чистоты влагалища и увидеть даже незначительные отклонения в составе секрета.
В норме в мазке должны отсутствовать посторонние болезнетворные микроорганизмы. Помимо этого, должно быть незначительное количество плоского эпителия, лейкоцитов и почти 90% лактобактерий. Последние считаются наиболее важными элементами, поскольку поддерживают во влагалище кислую среду.
https://www.youtube.com/watch?v=ytadvertiseru
Мазок на эубактерии показывает количество этих микроорганизмов во влагалище, а также степень поражения слизистых оболочек. Стоит отметить, что подобные возбудители не могут выжить в кислой среде, поэтому в случае их обнаружения можно говорить о серьезном дисбактериозе и изменении кислотно-щелочного равновесия.
При исследовании мазка учитывается не только количество эубактерий, но и число других клеток, которые всегда присутствуют в материале. При этом учитываются нормальные показатели и степень отклонения.
| Показатель | Норма и отклонения |
| Лейкоциты | В норме должно быть не более 1-2 клеток в поле зрения. При превышении показателя говорят о начале воспалительного процесса |
| Плоский эпителий | В норме должно быть не более 10 клеток в поле зрения. Но при воспалении или проникновении болезнетворных микроорганизмов происходит резкое повышение количества клеток |
| Слизь | Количество слизи должно быть незначительное, она должна быть вязкой, прозрачной, без посторонних примесей и неприятного запаха. Если же происходит изменение микрофлоры, слизь становится густой, количество ее увеличивается, появляется примесь гноя |
| Лактобактерии | В норме их количество составляет 90-95% от общего числа всех микроорганизмов. При воспалении или дисбактериозе число их резко снижается. В запущенных случаях количество составляет всего 5-10% |
| Дрожжи | При нормальной микрофлоре дрожжевых клеток не более 5% от общего числа. Вагиноз, дисбактериоз, кольпит всегда сопровождается повышением уровня дрожжевых клеток |
| Эубактерии | Превышение показателя 15 КОЕ/мл считается отклонением и поводом для назначения дополнительной диагностики |
| Другие микроорганизмы | При запущенных заболеваниях в анализе не только обнаруживается дисбактериоз. Специалист при диагностике выявляет гонококки, трихомонады, гарднареллы или другие бактерии, провоцирующие заболевания |
Pathogenesis
In areas where diphtheria is endemic, C. diphtheriae in the nasopharyngeal passageways is common. The exotoxin of Corynebacterium diptheriae is absorbed in the blood which in turn kills heart, kidney, and nerve cells by blocking protein synthesis. Toxigenic strains in susceptible individuals can cause disease by multiplying and secreting diphtheria toxin into either skin or nasopharyngeal lesions. The diphtheritic lesion is often covered by a pseudomembrane composed of fibrin, bacteria, and inflammatory cells. Diphtheria toxin can be proteolytically cleaved into two fragments: an N-terminal fragment A (catalytic domain), and fragment B (transmembrane and receptor binding domain). Fragment A catalyzes the NAD+ -dependent ADP-ribosylation of elongation factor 2, thereby inhibiting protein synthesis in eukaryotic cells. Fragment B binds to the cell surface receptor and facilitates the delivery of fragment A to the cytosol.
Corynebacterium glucuronolyticum
Corynebacterium glucuronolyticum — микроорганизмы, выделенные от людей с заболеваниями мочеполовой системы. Они являются возбудителями простатита и уретрита у мужчин,но могут в оптимальном количестве обитать в организме здоровых людей, являясь представителями данного биоциноза.

Под воздействием негативных факторов происходит активный рост и размножение Corynebacterium glucuronolyticum. Бактерии начинают приобретать болезнетворные свойства, вызывая местное воспаление. Паренхима предстательной железы отекает, увеличивается в размере, инфильтрируется лимфоцитами. Воспаление распространяется на околожелезистую ткань, изменяется структура органа, разрушаются эпителиоциты, утрачивается секреторная функция железы.
Дифтероиды входят в состав нормоциноза урогенитального тракта мужчин наряду со стафилококками, энтерококками, единичными микоплазмами и уреаплазмами. В процессе сексуальной активности уретра заселяется потенциальными уропатогенными бактериями. При переохлаждении, нервном перенапряжении, длительном приеме антибиотиков возникает воспаление в простате, обусловленное условно-патогенными бактериями. При этом нарушаются функции местных факторов защиты организма.
Больные с простатитом или уретритом, вызванном Corynebacterium glucuronolyticum, жалуются на боли в промежности, мошонке, половом члене, усиливающиеся в конце акта мочеиспускания; дизурические расстройства: полиурию, никтурию, неполное опорожнение мочевого пузыря, слабую струю; половую слабость — расстройства эрекции и эякуляции.
Диагностические мероприятия:
- Пальпация предстательной железы per rectum — изменение размеров железы, гетерогенная консистенции, чередование плотных и мягких участков, болезненные ощущения.В гемограмме — признаки воспаления.
- Бактериологическое исследование мочи и секрета простаты проводится в микробиологической лаборатории. Биоматериал засевают на стандартные среды для первичной идентификации, микроскопируют выросшие колонии, а затем изучают структуру, физиологию, ферментативную и биохимическую активность выделенного возбудителя. Corynebacterium glucuronolyticum хорошо растут на кровяном агаре. Через 24 часа на нем появляются выпуклые колонии беловато-желтоватого оттенка без зон гемолиза.
- ПЦР-диагностика — определение генетического материала коринебактерий в исследуемом образце.
Лечение простатита и уретрита противомикробное. Больным назначают фторхинолоны, макролиды и тетрациклины.
Corynebacterium glucuronolyticum — возбудитель заболеваний урогенитального тракта у мужчин. На сегодня инфекционный простатит и уретрит являются довольно распространенными недугами и серьезной медицинской проблемой. Специфические диагностические методы и терапевтические принципы остаются до конца не изученными. Больные, «заработав» подобный недуг, мучаются всю жизнь. Только эффективное антимикробное лечение поможет им справиться с патологией.
Listeria monocytogenes
Из других грамположительных палочковидных микроорганизмов, с которыми иногда приходится встречаться в клинической практике хирургам, следует отметить представителей рода Listeria, (наибольшее значение в патологии человека имеет L. monocytogenes). Листерии широко распространены в природе: их выделяют из почвы, воды, молочных и мясных пищевых продуктов. У человека и животных описано бессимптомное носительство листерий. Клинически выраженный листериоз (менингиты, энцефалиты, сепсис) встречается либо у пациентов экстремальных возрастных групп (новорожденных и пожилых), либо на фоне состояний, сопровождающихся нарушением клеточного иммунитета. У беременных листериоз может протекать в виде гриппоподобного заболевания, сопровождающегося бактериемией. При отсутствии лечения возможно развитие амнионита с инфицированием плода.
Контаминированные листериями продукты питания (чаще молочные) могут служить причиной вспышек пищевых инфекций у пациентов, относящихся к группам риска.
Диагностика листериоза основана на классических микробиологических методах, экспрессные методы отсутствуют
Важность своевременной диагностики листериоза определяется тем, что эти микроорганизмы обладают природной устойчивостью к цефалоспоринам и умеренной устойчивостью к фторхинолонам. Следовательно, эмпирическое применение этих антибиотиков будет не эффективным.
Существенное значение в патологии человека имеют представители рода Bacillus — грамположительные спорообразующие бациллы
Большинство этих микроорганизмов относится к сапрофитам. Их естественной средой обитания является почва, а благодаря способности к формированию эндоспор они крайне устойчивы к внешней среде. Единственным, но крайне важным облигатным патогеном среди представителей рода Bacillus является возбудитель сибирской язвы — Bacillus anthracis. Благодаря способности к спорообразованию микроорганизм неограниченно долго сохраняется в могильниках скота, павшего от сибирской язвы, создавая потенциальную угрозу заражения для животных и человека.
Человек сравнительно устойчив к сибирской язве, при кожных формам летальность не превышает 20% даже при отсутствии лечения. Кишечные формы, связанные с употреблением инфицированного мяса, и первично-легочные формы, связанные с вдыханием аэрозоля спор, протекают значительно тяжелее и сопровождаются высокой летальностью. Передача инфекции от человека к человеку наблюдается крайне редко.
Значение в патологии человека Bacillus cereus в первую очередь определяется продукцией двух токсинов: термолабильного и термостабильного, вызывающих пищевые отравления. В. cereus является вторым по значимости после S. aureus этиологическим агентом эндофтальмитов.
У иммунокомпрометированных пациентов В. cereus нередко вызывает тяжелые инфекции самой различной локализации (пневмонии, менингиты, остеомиелиты, абсцессы). Вполне возможно, что этиологическая роль В. cereus недооценивается, поскольку из-за широкого распространения в окружающей среде эти микроорганизмы чаще всего расценивают как контаминирующие клинические образцы. Изредка заболевания у иммунокомпрометированных пациентов могут вызывать В. licheniformis, В. subtilis, В. circulans и другие.
В целом представителей рода Bacillus следует рассматривать как вполне реальные оппортунистические патогены и соответственно необходимо больше внимания уделять их корректной идентификации и оценке их клинической значимости.
Аэробные актиномицеты представляют собой таксономически крайне разнообразную группу микроорганизмов, среди которых медицинское значение имеют около 20 родов, а количество видов в пределах некоторых из них начисляется сотнями. Естественным местом обитания аэробных актиномицетов служат почва и вода. Авробные актиномицеты являются оппортунистическими патогенами у иммунокомпрометированных пациентов, на фоне ВИЧ-инфекции.
Значительно чаще других актиномицетов заболевания у человека вызывают Nocardia asteroides, N. brasiliensis, Rhodococcus equi, Actinomadura madure. К наиболее тяжелым клиническим формам относятся инвазивные легочные инфекции с быстрым развитием некротических поражений. В ряде случаев легочные поражения прогрессируют медленно. К вторым по частоте клиническим проявлениям относятся инфекции кожи и мягких тканей различной тяжести (от нетяжелых хронических язвенных поражений до тяжелых форм с генерализацией процесса). В регионах с тропическим климатом возможны инфекции и у иммунокомпетентных лиц (мицетомы).
Ерюхин И.А.
Опубликовал
Эпидемиология дифтерии
Дифтерия встречается во всех странах мира. Массовая плановая иммунизация детского населения в РФ привела к резкому падению заболеваемости и смертности от данного заболевания. Максимум больных дифтерией регистрируется осенью и зимой.
Кто является источником инфекции
- Максимальная интенсивность выделения патогенных бактерий отмечается у больных дифтерией зева, гортани и носа. Наименьшую опасность представляют больные с поражением глаз, кожных покровов и ран. Больные дифтерией являются заразными в течение 2-х недель от начала заболевания. При своевременно начатом лечении заболевания антибактериальными препаратами этот срок сокращается до 3 — 5 дней.
- Лица, выздоравливающие после перенесенного заболевания (реконвалисцентны), могут оставаться источником инфекции до 3-х недель. Сроки прекращения выделения дифтерийных палочек затягиваются у больных с хроническими заболеваниями носоглотки.
- Больные, у которых заболевание не было своевременно распознано, представляют особую эпидемиологическую опасность.
- Здоровые лица, носители токсигенных штаммов дифтерийных палочек, так же являются источником инфекции. Несмотря на то, что их численность в сотни раз превышает число больных дифтерией, интенсивность выделения бактерий у них снижена в десятки раз. Бактерионосительство ничем себя не проявляет, в связи с чем контролировать распространение инфекции не представляется возможным. Данная категория лиц выявляется при массовых обследованиях в случаях вспышек дифтерии в организованных коллективах. До 90% случаев заболеваний дифтерией возникают в результате инфицирования токсигенными штаммами возбудителей дифтерии от здоровых носителей.
Носительство дифтерийных палочек бывает транзиторным (однократным), кратковременным (до 2-х недель), среднепродолжительным (от 2-х недель до 1-го месяца), затяжным (до полугода) и хроническим (более 6-и месяцев).
Больные и бактерионосители — основные источники инфекции
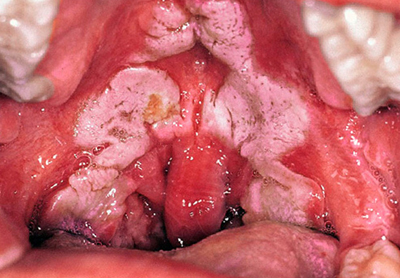
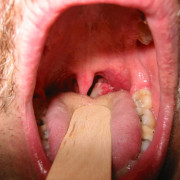
Рис. 8. На фото дифтерия зева. Заболевание составляет до 90% всех случаев заболевания.
Пути передачи дифтерии
- Воздушно-капельный — основной путь передачи инфекции. Дифтерийные палочки попадают во внешнюю среду с мельчайшими капельками слизи из носа и глотки при разговоре, кашле и чихании.
- Обладая большой устойчивостью во внешней среде, возбудители дифтерии долгое время сохраняются на различных предметах. Предметы быта, посуда, игрушки ребенка, белье и одежда могут стать источником инфекции. Контактный путь передачи инфекции является второстепенным.
- Грязные руки, особенно при дифтерийном поражении глаз, кожных покровов и ран, становятся фактором передачи инфекции.
- Зарегистрированы пищевые вспышки заболевания при употреблении инфицированных продуктов питания — молока и холодных блюд.
Максимум больных дифтерией регистрируется в холодное время года — осенью и зимой
Дифтерией болеют люди всех возрастов, у которых иммунитет к заболеванию отсутствует или утрачен в результате отказа человека от вакцинации.
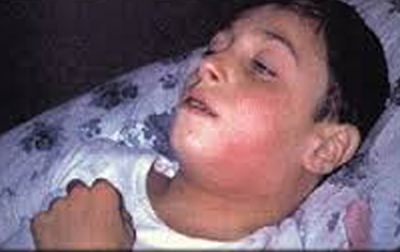
Рис. 9. На фото токсическая форма дифтерии у ребенка.
Восприимчивый контингент
Дифтерией болеют люди всех возрастов, у которых иммунитет к заболеванию отсутствует в результате отказа от вакцинации. 80% детей в возрасте до 15-и лет, заболевших дифтерией, оказываются не привитыми от заболевания. Максимум заболеваний дифтерией приходится на возраст 1 — 7 лет. В первые месяцы жизни дети находятся под защитой пассивного антитоксического иммунитета, который передается от матери через плаценту и грудное молоко.
Иммунитет к дифтерии формируется после перенесенного заболевания, в результате бактерионосительства (скрытая иммунизация) и вакцинации.
Спорадические вспышки дифтерии возникают при заражении от носителей инфекции, среди непривитых от данного заболевания, неполноценно иммунизированных и рефрактерных (иммунологически инертных) детей.
Наличие у человека специфических антител в количестве 0,03 АЕ/мл обеспечивает полноценную защиту от дифтерии.
Выявляется состояние восприимчивости к дифтерии по результатам реакции Шика, которая заключается во внутрикожном введении раствора дифтерийного токсина. Покраснение и папула размером более 1 см считается положительной реакцией и свидетельствует о восприимчивости к дифтерии.
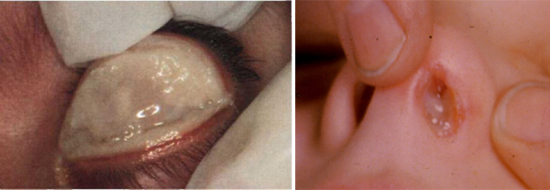
Рис. 10. На фото дифтерия глаз и носа.