Свяжитесь с нами
Содержание:
Referencias
- Hume E, Willcox M. Aparición de Serratia marcescens como un patógeno de superficie ocular. Arch Soc Esp Oftalmol. 2004; 79 (10): 475-481
- Ryan KJ, Ray C. Sherris. Microbiología Médica, 2010. 6° Ed. McGraw-Hill, New York, U.S.A
- Koneman, E, Allen, S, Janda, W, Schreckenberger, P, Winn, W. (2004). Diagnóstico Microbiológico. (5ta ed.). Argentina, Editorial Panamericana S.A.
- Hover T, Maya T, Ron S, Sandovsky H, Shadkchan Y, Kijner N. Mitiagin Y et al. Mecanisms of bacterial (Serratia marcescens) Attachment to, migration along, and killing of fungal Hyphae. Appl Environ Microbiol. 2016; 82 (9): 2585-2594.
- Wikipedia contributors. Serratia marcescens. Wikipedia, The Free Encyclopedia. August 14, 2018, 16:00 UTC. Tomado de wikipedia.org.
- Sandrea-Toledo L, Paz-Montes A, Piña-Reyes E, Perozo-Mena A. Enterobacterias productoras de ß-lactamasas de espectro extendido aisladas de hemocultivos en un Hospital Universitario de Venezuela. Kasmera. 2007; 35 (1): 15-25. Disponible en: Scielo.org
- Murdoch S, Trunk K, English G, Fritsch M, Pourkarimi E, and Coulthurst S. The Opportunistic Pathogen Serratia marcescens Utilizes Type VI Secretion To Target Bacterial Competitors. Journal of Bacteriology. 2011; 193(21): 6057–6069.
- Margate E, Magalhães V, Fehlberg l, Gales A, and Lopes. Kpc-producing Serratia marcescens in a home-care patient from recife, Brazil. Revista Do Instituto de Medicina Tropical de São Paulo, 2015; 57(4), 359–360.
Анаэробные возбудители
Анаэробные возбудители в большинстве своем являются представителями нормальной флоры человека, вызывая патологические процессы при снижении иммунной реактивности (анаэробная ангина) и/или барьерных функций (пупочная ранка, повреждение слизистых, операции, занос в легкое при аспирации или бронхоскопии), чаще всего как сопутствующая другим возбудителям нозокомиальная инфекция. Анаэробные посевы оправданы у истощенных детей с пролежнями, нейтропенией, при абдоминальной патологии, низкой гигиене рта, обширной травме и т.д.
Бактероиды. Bacteroides — грам-отрицательиые факультативно анаэробные неспорообразующие палочки. Prevotella melaninogenicus и P. oralis (ранее относившиеся к бактероидам) обитают в ротовой полости, представители группы В. fragilis — в толстом кишечнике, являясь основой его бактериальной популяции (1010 особей в 1 г кала);
https://www.youtube.com/watch?v=upload
Лекарственная чувствительность бактероидов практически 100%-ная к клиндамиципу, а также к метронидазолу, хлорамфениколу, карбапенемам, фторхинолонам. Превотеллы ротовой полости обычно чувствительны к амино- и уреидопенициллинам, но с учетом возможности выработки лактамаз препаратами выбора являются ингибитор-защищенные пенициллины и цсфалоспорины.
Терапия. Препарат выбора — клиндамицин, эффективны ингибитор-защищенные амино- и уреидопенициллины, цефоперазон/сульбактам. В терапию вероятно анаэробных процессов (в т.ч. бактериемии) часто эмпирически включают метроиидазол.
Clostridium difficile. С. difficile — спорообразующий облигатный грам-положительная анаэроб, выделяющий токсины А и В. Обитает в почве и часто колонизирует кишечник, особенно у детей 1-го года жизни. Основной фактор риска — нарушение нормальной микрофлоры кишечника при массивной антибактеральной терапии (особенно, но не исключительно пенициллинами, цефалоспоринами, клиндамицином), что создает условия для размножения возбудителя и продукции им токсинов. Играет роль и госпитализация при наличиии в отделении носителя клостридий. Инкубационный период не известен.
Лекарственная чувствительность к метронидазолу и ванкомицину.
Клинические проявления. Псевдомембранозный колит — обычно развивается в стационаре на фоне антибиотика, но иногда — через несколько недель после выписки.
Диагностические тесты. Высев возбудителя диагностического значения не имеет. Поскольку клинические проявления связаны с воздействием токсинов, их выявление в кале (есть ИФА- системы) — основной метод
К сожалению, у здоровых носителей клостридий в возрасте до 1 года также можно выявить токсины, так что важно исключить другие инфекции. Характерные изменения выявляются при эндоскопии
Пептострептококки. Peptostreptococcus spp. — наиболее важная в клиническом отношении группа анаэробных кокков ротовой полости, желудочно-кишечного тракта, влагалища. Часто высевается из анаэробных абсцессов, обычно вместе с бактероидами.
Лекарственная чувствительность к природным и полусиптетическим пенициллинам, цефалоспоринам, карбапенемам, клиндамицину, хлорамфениколу, на 80-90% — к фторхинолонам.
Клинические проявления. Специфическую роль пептострептококков, выявляемых обычно вместе с другими анаэробами, установить трудно.
Терапия. Выбор препаратов для лечения инфекции бактероидами бывает обычно эффективным и в отношении пептострептококков.
Источники и структура
Источники
Серрапептаза представляет собой протеолитический фермент, который, как утверждается, имеет противовоспалительные, противоотечные и аналгезирующие свойства и, по-видимому, активен после перорального приема капсулы с энтеросолюбильным покрытием . Названия брендов включают Danzen, Serodase, Nemesulide и Antiflazym.
Серрапептаза производится из бактерий Serratia, обнаруженных в кишечнике тутового шелкопряда (Bombyx mori), поэтому иногда серраптаптазу называют «ферментами шелкопряда». Среди различных видов бактерий Serratia, которые могут продуцировать ферменты протеазы (indica, marcescens, plymuthica и piscatorum), Serratia marcescens имеет особый штамм, известный как E15 (ATCC 13880), который до трех раз более продуктивен, и, хотя marcescens вообще более подходит для производства серрапептазы, предпочтение отдается штамму E15.
Серрапептаза – не единственный фермент, обнаруживаемый у этих бактерий, однако, он является основным производимым ферментом (также производятся три других больших, но менее распространенных фермента) .
Состав
Фермент серрапептаза имеет молекулярную массу 45 000-60 000Да (по другой информации, 50,6 кДа), и состоит из 470 аминокислот в длину; он классифицируется как металлопротеаза из-за содержания в нем молекулы цинка, которая помогает катализировать его ферментативную активность. Хотя он показывает максимальную активность при 40 °С и рН 9,0, он полностью инактивируется при 55 °С в течение 15 мин и имеет изоэлектрическую точку 5.3.
Специфичность субстрата, по-видимому, несколько схожа со специфичностью термолизина (полученного из bacillus thermoproteolyticus), и аминокислотная последовательность не содержит серосодержащих аминокислот (цистеин и метионин).
Представляется, что он является довольно крупным ферментом металлопротеазы, который может быть инактивирован (стать бесполезным) при избыточном тепле.
Uses and misuse
Role in biowarfare testing
Until the 1950s, S. marcescens was erroneously believed to be a nonpathogenic «», and its reddish coloration was used in school experiments to track infections. During the Cold War, it was used as a simulant in biological warfare testing by the U.S. military, which studied it in field tests as a substitute for the tularemia bacterium, which was being weaponized at the time.
On 26 and 27 September 1950, the U.S. Navy conducted a secret experiment named «Operation Sea-Spray» in which balloons filled with S. marcescens were released and burst over urban areas of the San Francisco Bay Area in California. Although the Navy later claimed the bacteria were harmless, beginning on September 29, 11 patients at a local hospital developed very rare, serious urinary tract infections. One of the afflicted patients, Edward J. Nevin, died. Cases of pneumonia in San Francisco also increased after S. marcescens was released. (That the simulant bacteria caused these infections and death has never been conclusively established. Nevin’s son and grandson lost a lawsuit they brought against the government between 1981 and 1983, on the grounds that the government is immune, and that the chance that the sprayed bacteria caused Nevin’s death was minute. The bacterium was also combined with phenol and an anthrax simulant and sprayed across south Dorset by US and UK military scientists as part of the DICE trials which ran from 1971 to 1975.
Since 1950, S. marcescens has steadily increased as a cause of human infection, with many strains resistant to multiple antibiotics. The first indications of problems with the influenza vaccine produced by Chiron Corporation in 2004 involved S. marcescens contamination.
Contaminated injectables
In early 2008, the U.S. Food and Drug Administration issued a nationwide recall of one lot of Pre-Filled Heparin Lock Flush Solution USP. The heparin IV flush syringes had been found to be contaminated with S. marcescens, which resulted in patient infections. The Centers for Disease Control and Prevention confirmed growth of S. marcescens from several unopened syringes of this product.
S. marcescens has also been linked to 19 cases in Alabama hospitals in 2011, including 10 deaths. All of the patients involved were receiving total parenteral nutrition at the time, and this is being investigated as a possible source of the outbreak.
Ground-water flow tracing
Because of its ability to be grown on agar plates into even, well coloured lawns, and the existence of a phage specific to S. marscecens, it has been used to trace water flows in Karst limestone systems. Known quantities of phage are injected into a fixed point in the Karst water system and the outflow of interest are monitored by conventional small-volume sampling at fixed time intervals. In the laboratory, the samples are poured onto grown S. marscecens lawns and incubated. Colourless plaques in the lawns indicate the presence of phage. The method was claimed to be sensitive at very high dilutions because of the ability to detect single phage particles.
Identification
S. marcescens is a motile organism and can grow in temperatures ranging from 5–40 °C and in pH levels ranging from 5 to 9. It is differentiated from other Gram-negative bacteria by its ability to perform casein hydrolysis, which allows it to produce extracellular metalloproteinases which are believed to function in cell-to-extracellular matrix interactions. Since this bacterium is a facultative anaerobe, meaning that it can grow in either the presence of oxygen (aerobic) or in the absence of oxygen (anaerobic), it is capable of nitrate reduction under anaerobic conditions. Therefore, nitrate tests are positive since nitrate is generally used as the final electron acceptor rather than oxygen. S. marcescens also exhibits tyrosine hydrolysis and citrate degradation. Citrate is used by S. marcescens to produce pyruvic acid, thus it can rely on citrate as a carbon source and test positive for citrate utilization. In identifying the organism, one may also perform a methyl red test, which determines if a microorganism performs mixed-acid fermentation. S. marcescens results in a negative test. Another determination of S. marcescens is its capability to produce lactic acid by oxidative and fermentative metabolism. Therefore, S. marcescens is lactic acid O/F+.
| Test | Result |
|---|---|
| Gram stain | − |
| Oxidase | − |
| Indole production | − |
| Methyl Red | > 70% − |
| Voges-Proskaeur | + |
| Citrate (Simmons) | + |
| Hydrogen sulfide production | − |
| Urea hydrolysis | > 70% − |
| Phenylalanine deaminase | − |
| Lysine decarboxylase | + |
| Motility | + |
| Gelatin hydrolysis, 22 °C | + |
| Acid from lactose | − |
| Acid from glucose | + |
| Acid from maltose | + |
| Acid from mannitol | + |
| Acid from sucrose | + |
| Nitrate reduction | + (to nitrite) |
| Deoxyribonuclease, 25 °C | + |
| Lipase | + |
| Pigment | some biovars produce red |
| Catalase production (24h) | + |
Упаковка, хранение и производитель
| Форма выпуска и упаковка | По 10 таблеток в контурной безъячейковой упаковке. Одна контурная безъячейковая упаковка вместе с инструкцией по медицинскому применению в картонной упаковке. По 10 картонных упаковок помещают в коробку из картона (10×10). По 30 таблеток в контурной безъячейковой упаковке. По 1, 5 и 10 контурных безъячейковых упаковок вместе с инструкцией по медицинскому применению помещают в картонную коробку. |
| Условия хранения | Хранить в защищенном от света месте, при температуре не выше 25°С. Хранить в недоступном для детей месте! |
| Срок хранения | З года. Не использовать после окончания срока годности, указанного на упаковке. |
| Условия отпуска из аптек | По рецепту |
| Производитель | Кусум Хелткер Пвт. Лтд., Индия |
черты
Общие характеристики и условия роста
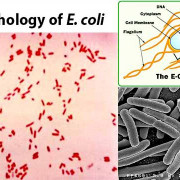
Serratia Marcescens Это факультативная аэробная палочка, подвижная, как и большинство энтеробактерий. Это вездесущий обитатель почвы, воды и поверхности растений. Поэтому обычно его можно найти во влажных средах, таких как ванные комнаты, водостоки, раковины, раковины и т. Д..
Он способен существовать в неблагоприятных условиях. Например, он может расти при температуре от 3,5 до 40 ° С. Кроме того, он может выживать в хлоргексидиновом мыльном растворе до концентрации 20 мг / мл..
В лаборатории это может расти при комнатной температуре (28 ° C), где у некоторых разновидностей развивается характерный пигмент кирпично-красных разновидностей, названных продигиозином. Но он также растет при 37 ° C, где его колонии имеют кремово-белый цвет, то есть при этой температуре он не образует пигмент.
Это представляет физиологическое фенотипическое изменение, стимулируемое температурой. Эта характеристика уникальна для этой бактерии, поскольку ни один другой вид семейства не способен это сделать..
Производство пигмента, несомненно, является очень полезным инструментом для постановки диагноза..
Что касается диапазона pH, который может поддерживать, это колеблется от 5 до 9.
Биохимические характеристики
Биохимически говоря Serratia Marcescens соответствует основным характеристикам, которые описывают полное семейство Enterobacteriaceae, то есть он ферментирует глюкозу, восстанавливает нитраты до нитритов и является отрицательной оксидазой.
Теперь у него есть другие биохимические характеристики, которые описаны ниже:
S. marcescens положительные тесты: Voges-Proskauer, цитрат, подвижность, лизин декарбоксилаза, орнитин и O-нитрофенил-β-D-галактопиранозид (ONPG) и каталаза.
В такой же степени это отрицательно сказывается на: производстве сероводорода (H2S), индол, фенилаланин-деаминаза, мочевина и аргинин.
Столкновение с метиловым красным тестом может быть переменным (положительным или отрицательным).
Наконец, перед поллиглигером происходит щелочная / кислотная реакция, то есть ферментируется глюкоза с образованием газа, но не лактоза..
Факторы вирулентности
Род Serratia выделяется в этом семействе, потому что он имеет 3 важных гидролитических фермента: липазу, желатиназу и внеклеточную ДНКазу. Эти ферменты способствуют инвазивной способности этого микроорганизма.
Он также содержит 3 хитиназы и белок, связывающий хитин. Эти свойства важны при деградации хитина в окружающей среде..
Кроме того, киназы предоставляют собственность S. marcescens противогрибкового действия на грибы Zygomycetes, клеточная стенка которых состоит в основном из хитина.
С другой стороны, S. marcescens Он способен формировать биопленки. Это представляет значительный фактор вирулентности, поскольку в этом состоянии бактерия более устойчива к действию антибиотиков..
Недавно было обнаружено, что некоторые штаммы S. marcescens они представляют систему секреции типа VI (T6SS), которая служит для секреции белков. Однако его роль в вирулентности еще не определена.
Устойчивость к противомикробным препаратам
Штаммы S. marcescens продуценты хромосомных бета-лактамаз AmpC.
Это дает им внутреннюю устойчивость к ампициллину, амоксициллину, цефокситину и цефалотину, поэтому единственным вариантом среди бета-лактамов для лечения штаммов, продуцирующих ESBL, являются карбапенемы и пиперациллин тазобактам..
Кроме того, он обладает способностью приобретать механизмы устойчивости к другим обычно используемым антибиотикам, в том числе аминогликозидам..
Штаммы S. marcescens производители кпк-2 и бла тэм-1. В этом случае карбапенемы уже не эффективны.
Первый штамм КПК за пределами больницы был изолирован в Бразилии, он был устойчив к азтреонаму, цефепиму, цефотаксиму, имипенему, меропенему, гентамицину, ципрофлоксацину и цефазидиму и был чувствителен только к амикацину, тигециклину и гатифлоксацину.
Фармакология
Абсорбция
Из-за того, что данная пищевая добавка является ферментом и разрушается в кислой среде желудка, для её употребления используются капсулы с кишечным покрытием (устойчивые к кислотности и, следовательно, распадающиеся в кишечнике, а не в желудке). Аквасомы (носитель, состоящий из нанокристаллического ядра, покрытого полигидрокси-олигомерами) действуют аналогично, при этом вещество стабильно в течение 2-6 часов в кислой среде (рН 1,2) и имеет линейную скорость высвобождения в щелочной среде (рН 7,4).
Серрапептаза разрушается в кислой среде желудка и поэтому для сохранения ее биологической активности требуется энтеральная капсула.
Было обнаружено, что, несмотря на то, что серапептаза является крупной белковой структурой, после перорального введения она абсорбируется в кишечнике крысы, хотя указывается, что крупная структура и возможный распад в кишечнике могут приводить к снижению биодоступности серапептазы (ферменты легко распадаются вследствие резких изменений рН и большие белковые структуры не могут быть хорошо поглощены ).
По-видимому, серапептаза в отдельности имеет низкую проницаемость в модели проницаемости кишечника Caco-2 (-7,72 +/- 0,51 см / с), которая, по-видимому, несколько улучшается с помощью систем липосомальной доставки (фосфатидилхолин до -7,47 +/- 0,36 см / с и 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламина до -6,5 +/- 0,35 см / с). Было отмечено, что это может несколько снижать абсорбцию серапептазы, поскольку клетки Caco-2 имеют более узкие щелевые соединения, чем в условиях in vivo (и, следовательно, меньший парацеллюлярный транспорт).
Считается, что усиленное поглощение серапептазы липосомами связано с увеличением парацеллюлярного переноса молекул липосомами (между клетками), при этом серапептаза слишком велика для транспортно-опосредованной абсорбции (и, вероятно, это опосредуется парацеллюлярным транспортом).
Что удивительно, серрапептаза поглощается через стенку кишечника, как бромелайн, и, как представляется, сохраняет свою ферментативную активность. По-видимому, он абсорбируется парацеллюлярно (между клетками), но, по-видимому, плохо поглощается, хотя это поглощение усиливается липосомами.
Считается, что серапептаза используется местно, хотя изопропилмиристат (ИПМ) или диметилсульфоксид (ДМСО) необходимы для усиления поглощения в коже (из-за того, что серапептаза является крупной ферментной структурой) и, согласно авторам, требовались при более высоких, чем приемлемые, концентрациях. В противоотечном тесте на крысах, местный гель (Monegyl 0100 с 10%, PEG 400 при 40%, пропиленгликоль на 10%, 1% серрапептаза и PEG 4000, добавленный до конъюгата смеси) был сопоставим по эффективности с диклофенак-гелем, что предполагает некоторую биологическую активность.
Другие способы доставки, о которых сообщалось, представляют собой систему на основе глицеринового моноолеата .
Имеются ограниченные свидетельства того, что серапептаза может быть биоактивной местно.
Сыворотка
Серрапептаза была обнаружена в сыворотке после пероральной дозы 100 мг / кг (крысы) до 0,87 +/- 0,41 нг / мл, а в лимфе у нее были более высокие концентрации 43 +/- 42 нг / мл при Tmax 15-30 минут. Минимальная доза 30 мг / кг была необходима для обнаружения какой-либо обнаруживаемой концентрации в плазме, но только 1 мг / кг для уровня в лимфатической ткани.
У крыс это вещество, по-видимому, проходит через кровь, связываясь с альфа-1 макроглобулином плазменной протеазы альфа-1 (α1M) в соотношении 1: 1; было отмечено, что ферментативная активность снижается примерно до 20%.
Распространение
Было обнаружено, что серрапептаза распространяется на участки воспаления у крысы до концентрации выше, чем в сыворотке.
Неферментирующие микроорганизмы
https://www.youtube.com/watch?v=ytdevru
В эту группу входят возбудители нозокомиальных инфекций, не ферментирующие, в отличие от большинства других возбудителей, глюкозу.
Лекарственная чувствительность к цефалоспоринам 3 поколения, уреидопени-инллинам, карбапенемам, но быстро вырабатывается устойчивость. Чувствительность к иминогликозидам и фторхинолонам непостоянна.
Клинические проявления: бактериемия, пневмония, послеоперационная инфекция рай, нервной системы.
Acinetobacter spp. A. baumannii, A. cacoaceticus и ряд других представителей вида — грам-отрицательные каталозо-положительные коккобациллы, не ферментирующие лактозу, родственные Neisseria и Moraxella, распространены в воде и почве, они колонизируют кожу (25% взрослых), респираторный тракт (5%), мочевые пути.
Частота колонизации возрастает у грахеостомированных и больных на ИВЛ; среди заболевших до половины дети с онкологической патологией, почти все — с центральным венозным катетером. Обнаруживается в местах высокой влажности — вентиляционных системах, увлажнителях, ингаляторах. Внебольничная инфекция крайне редка.
Лекарственная чувствительность больничных штаммов набольшая к амикацину п чмитнему, в последние 2 десятилетия она снижается из-за выработки лактамаз, в т.ч. металлл-бета-лактамазы (МБЛ). Нарастает устойчивость и к аминогликозидам (в России — 68-89%), цефалоспоринам 3-4 поколений (64-98%) и фторхинолонам (62-74%).
Клинические проявления: ИВЛ-ассоциированная пневмония, бактериемия, менингит, ИМИ, абдоминальный сепсис, инфекция мягких тканей.
Буркхолдерия сепация. Burkholderia (ранее Pseudomonas) sepacia — грамотрицательная подвижная не спорообразующая палочка. Обитает в воде и почве, ее находятся на овощах и фруктах, она вызывает гниение лука («скользкая кожура»). Растет на обычных средах, но медленно (1 дня до появления идентифицируемых колоний), поэтому о возможности его высева (муковисцидоз!
Лекарственная чувствительность изначальная к аминопенициллинам, цефалоспоринам 3 поколения, карбапенемам, хлорамфениколу, тобрамицину, ко-тримоксазолу, фторхинолонам, однако у большинства штаммов, выделенных у больных муковисцидозом, наблюдается множественная лекарственная устойчивость.
Клинические проявления. У иммунокомпетентных лиц возбудитель вызывает но-юкомиальные ИМП, пневмонии, сепсис, протекающие без особой тяжести. У больных муковисцидозом и хронической гранулематозной болезнью развиваются тяжелые пневмонии, при инфицировании пересаженного легкого летальность достигает 80%.
Терапия. Эмпирически: тобрамицин или ципрофлоксацин цефтазидим или защищенный уреидопенициллин. Альтернативы: карбапенем, хлорамфеникол.
Псевдомонады. Pseudomonas aeruginosa (из-за выработки синего пигмента известен как сине-гнойная палочка) — широко распространенный микроорганизм, обитающий в сырых местах — сливах раковины, ванн, душевых поддонов, увлажнителях, аэрозольных аппаратах. Колонизация наблюдается часто, выделение их из клинических проб в отсутствие проявлений диагностического значения пе имеет.
Клинические проявления практически неотличимы от вызванных энтеробакте-риями, при плеврите, ожоговом нагноении; характерен синеватый вид гноя.
Терапия. Эмпирически: карбапенемы, цефепим, цефтазидим, ципрофлоксацин, в т.ч. с аминогликозидами.
Stenotrophomonas. S. maltophilia — грам-отрицательиая аэробная палочка, широко распространенная во внешней среде, нередко выделяется из кала. Инфицирует больных на иммуносу-прессии, длительно получающих антибиотики, имеющих внутривенные катетеры.
https://www.youtube.com/watch?v=cosamomglavnom
Лекарственная чувствительность к ко-тримоксазолу. Металло-бета-лактамазы (МБЛ) делают его устойчивым ко всем (3-лактамам, в т.ч. карбапенемам.
Клинические проявления: септицемия, раневая инфекция, пневмония, ИМИ.
Терапия. Ко-тримоксазол в комбинации с защищенными пенициллинами и фторхинолоном. Используют и доксициклин или ципрофлоксацин тикарциллин/клавуланат.
Показания
Когда назначают препарат «Серрата» (таблетки)? Отзывы врачей сообщают, что прием этого лекарства должен осуществляться только после консультации с доктором.
Данный медикамент назначают при лечении разных заболеваний.
- В отоларингологии: при синуситах, отитах и прочих воспалениях, которые сопровождаются увеличенным слизеобразованием и затрудненным отделением мокроты. Также этот медикамент используют для улучшения абсорбции антибиотиков.
- В хирургии и травматологии: при переломах, растяжениях связок, вывихах и прочих травмах. Кроме того, такие таблетки применяют при отеках и с профилактической целью вероятного отторжения трансплантата.
- В дерматологии: при острых дерматозах, протекающих с болевым синдромом.
- В пластической хирургии: для уменьшения отечности после операции и увеличения микроциркуляции при профилактике вероятного отторжения трансплантата.