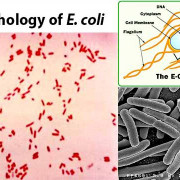
Вирус бешенства микробиология кратко
Содержание:
- Содержание
- III. Биологическая проба
- I. Микроскопические исследования
- Вирус бешенства. Флавивирусы
- Что провоцирует проявления
- Опасность отсутствия лечения
- Профилактика и вакцинация
- Virologie
- Возбудитель бешенства. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика
- Что влияет на риск заражения вирусом бешенства
- Virology
- Testing
- Примечания
- Диагностический процесс
- Патогенетические особенности
Содержание
-
Слайд 1
Департамент здравоохранения города Москвы ГБОУ СПО Медицинский колледж №4
Выполнила: Тямина И.И 301 -
Слайд 2
Бешенство — это заболевание вирусной природы, возникающее после укуса зараженного животного, характеризующееся тяжелым поражением нервной системы и заканчивающееся, как правило, смертельным исходом.
-
Слайд 3
Вирус бешенства (Neuroryctesrabid) относится к группе миксовирусов рода Lyssavirus семейства Rhabdoviridae. Обнаруживается в слюне, а также в слезах и моче.
-
Слайд 4
Вирус нестоек во внешней среде — погибает при нагревании до 56.С за 15 минут, при кипячении за 2 минуты. Чувствителен к ультрафиолетовым и прямым солнечным лучам, к этанолу и ко многим дезинфектантам. Однако устойчив к низким температурам, к фенолу, антибиотикам.
-
Слайд 5
После проникновения в организм вирус бешенства распространяется по нервным окончаниям, поражая практически всю нервную систему. Наблюдаются отек, кровоизлияния, дегенеративные и некротические изменения нервных клеток головного и спинного мозга.
-
Слайд 6
Источником вируса бешенства являются как дикие, так и домашние животные.
К диким относятся :
волки,
лисицы,
шакалы,
еноты,
барсуки,
скунсы,
летучие мыши,
грызуны -
Слайд 7
К домашним :
собаки,
кошки,
лошади,
свиньи,
мелкий и крупный рогатый скот. -
Слайд 8
Заражение бешенством от больного животного возможно при следующих обстоятельствах:
1) При укусе больного животного
2) При попадании слюны больного животного на поврежденные участки кожи (царапины, ссадины, раны) -
Слайд 9
Инкубационный период составляет от 10 дней до 3—4 (но чаще 1—3) месяцев.
-
Слайд 10
слабость,
головная боль,
общее недомогание,
отсутствие аппетита,
незначительное повышение температуры,
кашель,
насморк,
боли в горле , животе,
рвота, понос.
Их можно списать на какие угодно болезни, но чаще всего ставят ошибочный диагноз респираторная или кишечная инфекция. -
Слайд 11
Болезнь имеет три периода:
Продромальный или начальный (период предвестников)
Длится 1—3 дня. Сопровождается повышением температуры до 37,2—37,3 °C, угнетённым состоянием, плохим сном, бессонницей, беспокойством больного. Боль в месте укуса ощущается, даже если рана давно зарубцевалась. -
Слайд 12
Стадия разгара (гидрофобия)
Длится 1—4 дня. Выражается в резко повышенной чувствительности к малейшим раздражениям органов чувств: яркий свет, различные звуки, шум вызывают судороги мышц конечностей. Водобоязнь, аэрофобия. Больные становятся агрессивными, буйными, появляются галлюцинации, бред, чувство страха. -
Слайд 13
Период параличей (стадия «зловещего успокоения»)
Наступает паралич глазных мышц, нижних конечностей. Тяжёлые паралитические расстройства дыхания вызывают смерть. Общая продолжительность болезни 5—8 дней, изредка 10—12 дней. -
Слайд 14
Методов лечения бешенства пока еще не придумали. При симптомах первой стадии болезни, практически неизбежен летальный исход.
Единственный способ спасти человека — предотвратить болезнь путем введения специальной вакцины против бешенства, но сделать это необходимо не позже 14-го дня со времени укуса. Наиболее рекомендуемая специфическая профилактика — это специфический иммуноглобулин и/или активная иммунизация — введение вакцины. -
Слайд 15
Введение вакцины проводят по следующей схеме: в день инфицирования (обращения) вакцину вводят по 1 мл 5 раз в/м в плечо или бедро, далее повторяют вакцинирование на 3, 7, 14 и 28-е сутки. И последнюю инъекцию необходимо сделать через 90 дней после первой. Только в таком случае создается хороший иммунитет.
Если же пострадавший от укуса человек был ранее привит его вакцинируют по иной схеме без применения иммуноглобулина. -
Слайд 16
Действия при укусе:
Необходимо немедленно промыть рану мылом, в течение 10 мин.
Вызвать скорую помощь или самостоятельно добраться до ближайшего травмпункта.
Посмотреть все слайды
III. Биологическая проба
11. Биологическую пробу на бешенство ставят, если получен отрицательный результат: при микроскопическом исследовании (тельца Бабеша-Негри не обнаружены), при серологических реакциях (специфический рабический антиген не выявлен), а также при выявлении атипичных включений. Биологическую пробу проводят на белых мышах или кроликах.
12. Опытных мышей или кроликов заражают 10 %-ной суспензией из исследуемого мозга на физиологическом растворе или мясопептонном бульоне с pH 7,2 — 7,4. Для приготовления суспензии используются те же участки головного мозга, из которых брали материал для микроскопического и серологического исследований.
Вырезанные участки головного мозга собирают в стерильную пробирку и взвешивают, а затем тщательно растирают в ступке пестиком, после чего добавляют физиологический раствор или мясопептонный бульон из расчета получения 10 %-ной суспензии. Полученную суспензию отстаивают в течение 10 мин и для заражения используют надосадочную жидкость.
Если патологический материал был загрязнен, то надосадочную жидкость сливают в другой сосуд (пробирку) и к ней добавляют по 500 — 1000 ЕД пенициллина и стрептомицина на 1 мл жидкости, после чего отстаивают еще 30 мин при комнатной температуре и затем используют для заражения. Суспензию необходимо готовить в стерильных условиях и при строгом выполнении правил личной профилактики.
Биологическая проба на белых мышах. Для заражения используют белых мышей массой 8 — 10 г. Для каждого исследования берут 6 мышей, из которых трех заражают в головной мозг, а трех — подкожно. При заражении в мозг иглу вводят в точке за линией, соединяющей задние углы и немного в стороне от линии, проходящей посередине головы. Место заражения протирают спиртом. Суспензию вводят в дозе 0,03 мл. Для предупреждения глубокого проникновения иглы в мозг на ее кончик надевают ограничитель — небольшой кусочек резиновой трубки, который укрепляют на расстоянии 2 — 3 мм от конца иглы. При подкожном заражении суспензию вводят в область кончика носа (в верхнюю губу) в дозе 0,05 мл. На месте введения суспензии образуется небольшая припухлость. Зараженных мышей помещают в стеклянные банки и наблюдают за ними в течение 30 дн. При положительном результате биологической пробы у мышей обычно на 7 — 15-й день после заражения развивается клиника паралитического бешенства.
Вначале отмечаются вялость, взъерошенность шерсти и своеобразная горбатость, а также нарушение координации движений. Затем наступает паралич задних конечностей, а позднее — передних, переходящих в общий паралич, заканчивающийся смертью. Продолжительность болезни 2 — 3 сут.
С развитием общего паралича мышей умерщвляют при помощи эфирного или хлороформенного наркоза. У павших и убитых мышей вскрывают черепную полость, делают засев из мозга на питательные среды, после чего извлекают головной мозг, из которого готовят препараты для микроскопического и иммунобиологических исследований.
При отсутствии клинических проявлений бешенства у зараженных мышей в течение 30 дн. их уничтожают. Банки, в которых они содержались, тщательно дезинфицируют.
Биологическая проба на кроликах. Для постановки биологической пробы берут четырех кроликов массой не менее 1,5 кг каждый. Двух кроликов заражают в мозг и двух внутримышечно в области бедра. Суспензию вводят интрацеребрально в дозе 0,2 мл, а внутримышечно — в дозе 2 мл.
При положительном результате биологической пробы кролики заболевают в течение 16 — 21 дня. Заболевание бешенством протекает у кроликов в тихой паралитической форме со смертельным исходом. У павших кроликов извлекают головной мозг и дальнейшее исследование проводят так же, как и при заражении мышей. Наблюдение за кроликами ведут в течение 45 — 50 дн. По истечении указанного срока кроликов уничтожают. Клетки, в которых содержались подопытные животные, дезинфицируют.
I. Микроскопические исследования
5. Для микроскопического исследования делают отпечатки и мазки из разных участков головного мозга.
6. Для приготовления отпечатка кусочки головного мозга (аммонов рог, кора полушарий, мозжечок, продолговатый мозг) кладут на фильтровальную бумагу, сложенную в 4 — 6 слоев. К поверхности среза несколько раз (3 — 4) подряд прикасаются чистым предметным стеклом, слегка надавливая его, чтобы на стекле получился тонкий отпечаток.
7. Мазки делают из тех же участков головного мозга. Для этого кусочки мозга растирают в фарфоровой ступке пестиком или в пробирке стеклянной палочкой до образования гомогенной массы, из которой делают грубые мазки на обезжиренном предметном стекле.
Можно делать мазки и другим способом. Для этого небольшой кусочек мозга кладут на край предметного стекла, а другим стеклом раздавливают его и размазывают от одного края до другого, в результате чего на поверхности стекла получается тонкий равномерный мазок.
8. Полученные мазки или отпечатки окрашивают одним из следующих способов:
а) окраска по Муромцеву. Изготовленные, еще влажные мазки или отпечатки сразу же фиксируют в этиловом или метиловом спирте или в смеси спирта пополам с эфиром или ацетоном (химически чистым) в течение 1 — 2 ч и после этого промывают водой. Сосуд с фиксатором должен быть хорошо закрыт, чтобы предупредить испарение фиксирующей жидкости. После промывания водой влажные мазки помещают на 5 — 10 мин в раствор краски Мансона, разведенной водой 1:40. Затем краску сливают и тут же мазки погружают в 10 %-ный водный раствор танина на 8 — 10 мин до появления голубоватой окраски. После этого мазки промывают водой, высушивают фильтровальной бумагой, проводят через смесь из равных частей спирта с ацетоном (химически чистым) или спирта с ксилолом и снова высушивают фильтровальной бумагой. Окрашенный мазок должен иметь светло-голубой фон, при этом ядра нервных клеток окрашиваются в синий цвет, а тельца Бабеша-Негри — в бледно-фиолетовый с темными включениями;
б) окраска по Селлерсу. На приготовленный влажный отпечаток или мазок наносят на 4 — 5 с смесь реактива «А» (метиленовый синий — 2 г, метиловый спирт без ацетона — 100 мл) и реактива «В» (основной фуксин — 0,5 г, этиловый спирт без следов ацетона — 100 мл). Рабочий раствор красителя состоит из 15 мл реактива «А», 2 — 4 мл реактива «В» и 25 мл метилового спирта. После окраски препарат промывают проточной водой и высушивают.
В окрашенном мазке цитоплазма нейронов ярко-синяя, ядрышки темно-синие, эритроциты кирпично-красные, тельца Бабеша-Негри пурпурно-красные с отчетливо видной базофильной структурой телец;
в) окраска по Михину. Мазки или отпечатки фиксируют в смеси спирта и эфира (поровну) в течение 5 — 10 мин, после чего их просушивают фильтровальной бумагой и окрашивают в течение 30 — 40 мин краской Гимза (1 — 2 капли на 1 мл дистиллированной воды), быстро промывают подкисленным спиртом (1 капля ледяной уксусной кислоты на 30 мл 96°-ного спирта), а затем водой, просушивают фильтровальной бумагой и подвергают исследованию. Если материал был в глицерине, то его предварительно хорошо прополаскивают в воде и просушивают фильтровальной бумагой.
В окрашенном препарате при микроскопическом исследовании основной фон должен быть красным с фиолетовым оттенком. При преобладании синего тона мазок снова обмывают подкисленным спиртом и промывают водой. Пирамидальные нервные клетки имеют синеватый цвет с интенсивно черным ядром, а тельца Бабеша-Негри — розово-красный с точечными включениями темно-синего цвета;
г) окраска по Борману—Гайнуллиной. Тонкие мазки или отпечатки в течение 5 мин фиксируют в смеси следующего состава: спирта и эфира (поровну) — 98 мл, ледяной уксусной кислоты — 2 мл; после фиксации их погружают на 5 мин в 10 % -ный раствор кристаллической соды, а затем промывают водой и просушивают на воздухе. Зафиксированные мазки в течение 2 мин окрашивают краской, приготовленной перед ее употреблением (насыщенного водного раствора метиленовой сини — 3 капли, насыщенного основного раствора фуксина — 2 капли, водопроводной воды — 20 мл). Раствор краски наливают на мазок, фиксируют над пламенем горелки, затем краску оставляют еще на одну минуту, после чего промывают водой и просушивают фильтровальной бумагой.
В окрашенном мазке основной фон должен быть ярко-красным, протоплазма нервных клеток окрашивается в красновато-синий цвет, а их ядра — в темно-синий, тельца Бабеша-Негри окрашиваются в землянично-красный цвет с типично гранулярной структурой. Эритроциты имеют вид неокрашенных кружочков.
Вирус бешенства. Флавивирусы
| 52. ВИЧ. Эпидемиология. Диагностика. Лечение | Вперед >>>54. Вирус гепатита А и В |
Скрыть рекламу в статье
53. Вирус бешенства. Флавивирусы
Вирус бешенства. Относится к семейству Rhabdoviridae, роду Lyssavirus.
Рабдовирусы отличают пулевидная форма, наличие оболочки, спиральная симметрия; геном образован РНК.
Бешенство – острая инфекция ЦНС, сопровождающаяся дегенерацией нейронов головного и спинного мозга. Летальность для человека при отсутствии своевременного лечения составляет 100 %.
Вирус проникает в организм человека через повреждения кожных покровов, как правило, при укусах больных животных. Вирус мигрирует по аксонам периферических нервов в базальные ганглии и ЦНС, где размножается в клетках, в результате чего появляются цитоплазматические тельца Бабеша-Негри. Далее вирус мигрирует обратно по центробежным нейронам в различные ткани.
Время продвижения вируса по нервным стволам соответствует инкубационному периоду заболевания. Его длительность может быть различной: минимальной (10–14 дней) при укусе в голову и лицо и более продолжительной (месяц и более) при укусах в конечности.
Резервуаром вируса в природе являются различные теплокровные животные.
Лечение:
1) антибиотики широкого спектра действия;
2) специфический антирабический иммуноглобулин;
3) лошадиная антирабическая сыворотка;
4) антирабическая вакцина.
Специфическая профилактика: антирабическая вакцина.
Флавивирусы
Семейство включает в себя около 50 вирусов.
Это сферические оболочечные вирусы с икосаэдральным нуклеокапсидом, заключенным в липидную оболочку.
Геном образует однонитевая молекула +РНК.
Флавивирусы культивируют в куриных эмбрионах и культурах тканей.
Семейство флавивирусов включает в себя различных представителей, вызывающих соответствующие заболевания:
1) вирус желтой лихорадки. Резервуар инфекции – обезьяны, переносчик – комары. Встречается в странах Южной Африки;
2) вирус лихорадки Денге. Резервуаром инфекции являются больные люди и обезьяны, переносчиком – комары;
3) вирус японского энцефалита. Резервуар возбудителя – дикие птицы, грызуны, крупный рогатый скот, лошади и свиньи; человек – тупиковый хозяин (при эпидемиях возможна трансмиссивная передача от человека человеку). Переносчики – комары рода Кулекс;
4) вирус клещевого энцефалита. Резервуар и переносчик вируса – иксодовые клещи. Дополнительный резервуар – различные животные и птицы.
Для специфической профилактики клещевого энцефалита применяют инактивированную вакцину. При укусе клеща вводят специфический иммуноглобулин.
| 52. ВИЧ. Эпидемиология. Диагностика. Лечение | Вперед >>>54. Вирус гепатита А и В |
Что провоцирует проявления
Провоцируют эти проявления различные факторы, это может быть большое количество воды, резкий сильный ветер, яркий свет, громкие звуки. Эти симптомы проявляются периодически и спонтанно, а в остальное время больной человек спокоен и адекватен. Дальше наступает следующая стадия, когда вирус бешенства у человека постоянно вызывает сильную потливость и чрезмерное слюноотделение. Изо рта постоянно течет слюна и идет пена. Кроме этого на этой стадии может регулярно появляться сильные приступы тахикардии.
Когда и эта фаза проходит, то наступает заключительный этап развития заболевания. Он характерен тем, что человек успокаивается, агрессия и раздражение отступают. Проявляются черепно-мозговые нарушения, может наступить паралич конечностей частичный или полный. В этот период больные люди как бы чувствует себя лучше, судороги уже так их не беспокоят, и они могут самостоятельно пить и есть. Но это улучшение сильно обманчиво, потому что меньше чем через сутки человек умрет от остановки сердца или спазма дыхательных путей. Это неизбежно, и смерть приходит к людям, зараженным бешенством внезапно без агонии и мучений.
Опасность отсутствия лечения
Опасность этой болезни заключается еще и в том, что если укушенный человек не обратился к врачу вовремя, то может развиться так называемое “тихое бешенство”. Оно протекает без таких ярко выраженных симптомов, и опасно тем, что человек может стать распространителем заболевания. Человек в течение долгого времени не чувствует ни каких проявлений и когда наступают судороги и нервные проявления, помочь больному уже нельзя. Если человек сразу не обратился к врачу и не получил вакцину или хотя бы консультацию он долго думает что все обошлось а когда проявляются симптомы сделать ни чего нельзя.
Профилактика и вакцинация
Профилактика и лечение вируса бешенства у человека заключается в том, что любой самый незначительный укус животного следует рассматривать как источник заражения. Только при таком подходе можно избежать заражения. Если человек получил укус животного, следует незамедлительно обращаться в больницу, не теряя ни минуты. Надо сказать, что вирус бешенства погибает при соблюдении всех правил предписанных врачом.При обращении нужно без сомнений и рассуждений отдаться воле специалиста и согласится на вакцинацию. Прививка от бешенства обычно проводится курсом в несколько приемов и если врач сделал такое назначение то нельзя прерывать этот курс, надо непременно закончить его. Вакцина от бешенства имеет название КОКАВ, и ее периодичность следующая:
Уколы делаются в первый день, на третьи сутки, на 7-е сутки, на 14-е сутки, на 30-е сутки, и на 90-е сутки. Прерывать этот курс также опасно, как и не обращаться к врачу. Нужно понимать, что вирус бешенства погибает при прохождении полного курса вакцинации.
После укуса собакой или кошкой следует установить наблюдение за нападавшей особью в течение десяти дней, если это возможно, вирусология бешенство выявляет у животных именно на этом этапе. Если у животного не проявятся признаки бешенства, то можно надеяться что все обойдется. И врач может предложить прекратить курс вакцинации.
Будьте бережны и внимательны к своему здоровью – выберите подходящего вам врача и запишитесь на приём по телефону: 8 (499) 969-20-36 (для жителей Москвы и Московской области).
2017-12-20T14:04:41+00:00
Virologie
Structuur
Lyssavirions omhuld met kogelvormige geometrieën. Deze virionen zijn ongeveer 75 nm breed en 180 nm lang. Lyssavirions spiraalvormige symmetrie hebben, zodat hun infectieuze deeltjes bij benadering cilindrische vorm. Dit is een typisch voorbeeld van plant-infecterende virussen. Virionen van mens-infecterende virussen vaker kubieke symmetrie en neem vormen benaderen regelmatige veelvlakken .
De structuur bestaat uit een puntige buitenste omhulling , een middengebied uit matrixeiwit M, en een binnenste ribonucleocapsid complex gebied, bestaande uit het genoom geassocieerd met andere eiwitten.
Genome
Lyssavirus genomen uit een negatieve-sense, enkelstrengs RNA- molecuul dat vijf virale eiwitten codeert: polymerase L, matrix -eiwit M, fosfoproteïne P, nucleoproteïne N en glycoproteïne G. Genomes lineair, ongeveer 11kb lang.
Op basis van recente phylogenetic bewijs, zijn lyssavirussen zijn onderverdeeld in zeven grote soorten . Daarnaast zijn er vijf meer soorten onlangs ontdekt: West-Kaukasische bat virus, Aravan virus, Khujand virus, Irkut virus en Shimoni bat virus. De belangrijkste soorten (genotypes) zijn: rabiësvirus ( genotype 1 ); Lagos bat virus ( genotype 2 ); Mokola-virus ( genotype 3 ); Duvenhage virus ( genotype 4 ); European Bat lyssavirussen type 1 en 2 ( genotypes 5 en 6 ); en Australische bat lyssavirus ( genotype 7 ).
Gebaseerd op de biologische eigenschappen van de virussen, zijn deze soorten verder onderverdeeld in phylogroups 1 en 2. Phylogroup 1 omvat genotypes 1, 4, 5, 6 en 7, terwijl phylogroup 2 omvat genotypen 2 en 3. De nucleocapside regio is lyssavirus vrij sterk behouden van genotype tot genotype over beide phylogroups; experimentele gegevens hebben aangetoond dat het enige lyssavirus gebruikte stammen vaccinaties zijn die van de eerste soort (bijv classic rabies) waardoor hun doeltreffendheid voor sommige niet-rabiës Lyssavirus ziekten (bijv Mokola-virus) in kwestie.
| Geslacht | Structuur | Symmetrie | Appelwants | genomische arrangement | Genomic segmentatie |
|---|---|---|---|---|---|
| lyssavirus | Kogelvormig | gehuld | Lineair | monopartiete |
Evolutie
Er zijn drie fylogeografische groepen lyssavirussen: 1 -3. Rabiës behoort tot groep 1 , met Aravan lyssavirus, bat Nederlandse lyssavirus, bat Bokeloh lyssavirus, Duvenhage virus, European bat lyssavirus 1 en 2, Gannoruwa knuppel lyssavirus, Irkut lyssavirus en Khujand lyssavirus. Leden van groep 2 zijn Lagos bat virus, Mokola virus en Shimoni bat virus. Leden van groep 3 behoren Ikoma lyssavirus en Lleida bat lyssavirus. Phyogenetic studies suggereren dat de oorspronkelijke hosts van deze virussen waren vleermuizen. Hoe groter antigene diversiteit van lyssavirussen van Afrika heeft geleid tot de veronderstelling dat Afrika was de oorsprong van deze virussen. Een onderzoek van 153 virussen verzameld tussen 1956 en 2015 vanuit verschillende geografische locaties heeft in plaats daarvan voorgesteld een Palearctic oorsprong (85% kans) voor deze virussen. Meest recente schattingen (95% kans) voor de meest recente gemeenschappelijke voorouder waren zeer breed — tussen 3995 en 166.820 jaar voor heden — en dat suggereert dat er verder werk te doen op dit gebied. Hoewel vleermuizen geëvolueerd in de Palearctic, hun oorsprong ouder zijn dan die van de lyassaviruses door miljoenen jaren, die pleit tegen hun co-speciatie. De evolutie tarief in de N-gen in de Africa 2 afkomst is geschat op 3,75 x 10 zijn -3 substituties per site per jaar. Deze prijs is vergelijkbaar met die van andere RNA-virussen.
Возбудитель бешенства. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика
Таксономия: РНК-содержащий вирус, семейство Rhabdoviride, род Lyssavirus.
Морфология и антигенные свойства.Вирион имеет форму пули, состоит из сердцевины (РНП (рибонуклеопротеин) спирального типа и матриксного белка), окруженной липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными (типоспецифический антиген) и иммуногенными свойствами. Антитела к нему нейтрализуют вирус и выявляются в РН(рекция нейтрализации). РНП состоит из геномной однонитевой линейной минус-РНК и белков: N-белка, L-белка и NS-белка. РНП является группоспецифическим антигеном; выявляется в РСК, РИФ, РП.
Различают два вируса бешенства: дикий вирус, циркулирующий среди животных, патогенный для человека; фиксированный – не патогенный для человека.
Культивирование.Вирус культивируют путем внутримозгового заражения лабораторных животных (мышей, крыс) и в культуре клеток: фибробластов человека, куриного эмбриона. В нейронах головного мозга зараженных животных образуются цитоплазматические включения, содержащие антигены вируса (тела Бабеша-Негри – эозинофильные включения).
Резистентность:Вирус бешенства неустойчив: быстро погибает под действием солнечных и УФ-лучей, а также при нагревании до 60С. Чувствителен к дезинфицирующим веществам, жирорастворителям, щелочам и протеолитическим ферментам.
Эпидемиология. Источниками инфекции в природных очагах являются волки, грызуны. Вирус бешенства накапливается в слюнных железах больного животного и выделяется со слюной. Животное заразно в последние дни инкубационного периода (за 2—10 дней до клинических проявлений болезни). Механизм передачи возбудителя — контактный при укусах. Иногда заболевание развивается при употреблении мяса больных животных или при трансплантации инфицированных тканей (роговицы глаза).
У собаки после инкубационного периода (14дн.) появляются возбуждение, обильное слюнотечение, рвота, водобоязнь. Она грызет место укуса, бросается на людей, животных. Через 1—3 дня наступают паралич и смерть животного.
Патогенез и клиника.Вирус, попав со слюной больного животного в поврежденные наружные покровы, реплицируется и персистирует в месте внедрения. Затем возбудитель распространяется по аксонам периферических нервов, достигает клеток головного и спинного мозга, где размножается. Клетки претерпевают дистрофические, воспалительные и дегенеративные изменения. Размножившийся вирус попадает из мозга по центробежным нейронам в различные ткани, в том числе в слюнные железы. Инкубационный период у человека при бешенстве — от 10 дней до 3 месяцев. В начале заболевания появляются недомогание, страх, беспокойство, бессонница, затем развиваются рефлекторная возбудимость, спазматические сокращения мышц глотки и гортани.
Иммунитет:Человек относительно устойчив к бешенству. Постинфекционный иммунитет не изучен, так как больной обычно погибает. Введение людям, укушенным бешеным животным, инактивированной антирабической вакцины вызывает выработку антител, интерферонов и активацию клеточного иммунитета.
Микробиологическая диагностика: Постмортальная диагностика включает обнаружение телец Бабеша—Негри в мазках-отпечатках или срезах из ткани мозга, а также выделение вируса из мозга и подчелюстных слюнных желез. Тельца Бабеша—Негри выявляют методами окраски по Романовскому—Гимзе. Вирусные антигены в клетках обнаруживают с помощью РИФ.
Выделяют вирус из патологического материала путем биопробы на мышах: заражают интрацеребрально. Идентификацию вирусов проводят с помощью ИФА, а также в РН на мышах, используя для нейтрализации вируса антирабический иммуноглобулин.
Прижизненная диагностика основана на исследовании: отпечатков роговицы, биоптатов кожи с помощью РИФ; выделении вируса из слюны, цереброспинальной и слезной жидкости путем интрацеребрального инфицирования мышей. Возможно определение антител у больных с помощью РСК, ИФА.
Лечение.Симптоматическое; эффективное лечение отсутствует.
Профилактика.Выявление, уничтожение животных. Иммунизация антирабической вакциной собак. Специфическую профилактику проводят антирабической вакциной и антирабической сывороткой или иммуноглобулином. Инактивированная УФ- или гамма лучами культуральная вакцина. С лечебно–профилактической целью иммунизируют людей; формируется активный иммунитет.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 10274 —
источник
Что влияет на риск заражения вирусом бешенства
Вероятность развития заболевания напрямую зависит от того, содержался ли во время ослюнения или укуса в слюне животного вирус. Так как примерно у 45-50% собак, больных бешенством, вирус не выделяется со слюной.
Несмотря на это, отсутствие эффективного лечения и стопроцентный уровень летальности, требуют обязательного проведения полного лечебно-профилактического комплекса после контакта с зараженным животным.
Насколько распространено заболевание
Болезнь распространена повсеместно (исключение составляют только Австралия, Океания и Антарктида). Каждый год от этой инфекции погибает около 70 тысяч человек по всему миру. Чаще всего случаи бешенства регистрируют на территории Азии, Африки и Латинской Америки.
В России каждый год регистрируется около тридцати случаев бешенства. При этом, в последние годы отмечается активизация природных очагов и рост заболеваемости.
Virology
Structure
Lyssavirions are enveloped, with bullet shaped geometries. These virions are about 75 nm wide and 180 nm long. Lyssavirions have helical symmetry, so their infectious particles are approximately cylindrical in shape. This is typical of plant-infecting viruses. Virions of human-infecting viruses more commonly have cubic symmetry and take shapes approximating regular polyhedra.
The structure consists of a spiked outer envelope, a middle region consisting of matrix protein M, and an inner ribonucleocapsid complex region, consisting of the genome associated with other proteins.
Genome
Lyssavirus genomes consist of a negative-sense, single-stranded RNA molecule that encodes five viral proteins: polymerase L, matrix protein M, phosphoprotein P, nucleoprotein N, and glycoprotein G. Genomes are linear, around 11kb in length.
Based on recent phylogenetic evidence, lyssaviruses have been categorized into seven major species. In addition, five more species have recently been discovered: West Caucasian bat virus, Aravan virus, Khujand virus, Irkut virus and Shimoni bat virus. The lyssavirus genus can be divided into four phylogroups based upon DNA sequence homology. Phylogroup I includes viruses, such as Rabies virus, Duvenhage virus, European bat lyssavirus types 1 and 2, Australian bat lyssavirus, Khujand virus, Bokeloh bat lyssavirus, Irkut virus, and Aravan virus. Phylogroup II contains Lagos bat virus, Mokola virus, and Shimoni bat virus. West Caucasian bat lyssavirus is the only virus that is a part of phylogroup III. Ikoma lyssavirus and Lleida bat lyssavirus are examples in phylogroup IV. West Caucasian bat lyssavirus was classified within its own phylogroup because it is the most divergent lyssavirus that has been discovered.
| Genus | Structure | Symmetry | Capsid | Genomic arrangement | Genomic segmentation |
|---|---|---|---|---|---|
| Lyssavirus | Bullet-shaped | Enveloped | Linear | Monopartite |
Evolution
Phyogenetic studies suggest that the original hosts of these viruses were bats. The greater antigenic diversity of lyssaviruses from Africa has led to the assumption that Africa was the origin of these viruses. An examination of 153 viruses collected between 1956 and 2015 from various geographic locations has instead suggested a Palearctic origin (85% likelihood) for these viruses. Date estimates (95% likelihood) for the most recent common ancestor were very broad — between 3,995 and 166,820 years before present — which suggests there is further work to be done in this area. Although bats evolved in the Palearctic, their origins antedate that of the lyassaviruses by millions of years, which argues against their co-speciation. The evolution rate in the N gene in the Africa 2 lineage has been estimated to be 3.75×10−3 substitutions per site per year. This rate is similar to that of other RNA viruses.
Testing
As of 2018 the direct fluorescent antibody (DFA) test is still the gold standard to detect lyssavirus infection. Since the new millennium reverse transcription PCR (RT-PCR) tests have been developed for rabies but only been used as a confirmatory test. Real-time PCR-based tests which have higher sensitivity and objective diagnostic thresholds and allow samples to be stored at room temperature have been promising since 2005, but require a real-time PCR machine, skilled workers with experience in molecular diagnostics. In an international evaluation a single TaqMan LN34 assay could detect Lyssavirus with high sensitivity (99.90%) across the genus and high specificity (99.68%) when compared to the DFA test. It will become the primary post-mortem rabies diagnostic test where possible.
Примечания
- Пиневич А. В., Сироткин А. К., Гаврилова О. В., Потехин А. А. Вирусология : учебник. — СПб. : Издательство Санкт-Петербургского университета, 2012. — С. 400. — ISBN 978-5-288-05328-3.
- ↑
- ↑
- Pawan, J. L. (1936). «Transmission of the Paralytic Rabies in Trinidad of the Vampire Bat: Desmodus rotundus murinus Wagner, 1840». Annals of Tropical Medicine and Parasitology 30: 137—156. ISSN 0003-4983.
- Pawan, J. L. (1936). «Rabies in the vampire bat of Trinidad, with special reference to the clinical course and the latency of infection». Ann Trop Med Parasitol 30: 101—129. ISSN 0003-4983
- Taylor PJ (December 1993). «A systematic and population genetic approach to the rabies problem in the yellow mongoose (Cynictis penicillata)». Onderstepoort J. Vet. Res. 60(4): 379—387. PMID .
- ↑
- McElhinney, L. M.; Marston, D. A.; Stankov, S; Tu, C.; Black, C.; Johnson, N.; Jiang, Y.; Tordo, N.; Müller, T.; Fooks, A. R. (2008). «Molecular epidemiology of lyssaviruses in Eurasia». Dev Biol (Basel) 131: 125—131. PMID .
Диагностический процесс
Диагностика бешенства начинается с изучения симптоматики и сбора эпиданамнеза
Важно установить факт контакта с инфицированным животным – наличие укуса, оцарапывания или ослюнения. Симптомы патологии весьма специфичны: гидрофобия, аэрофобия, судороги и спазмы мышц, гиперсаливация, отвисшая челюсть и прочие
Врачи наблюдают за больным и отмечают мидриаз, странное поведение, тяжелое дыхание.
Результаты вирусологического исследования и серодиагностики имеют решающее значение при постановке диагноза. В лаборатории исследуют биоматериал от больного – ликвор, слюну, мозговую ткань, ставят биопробы, определяют антитела.
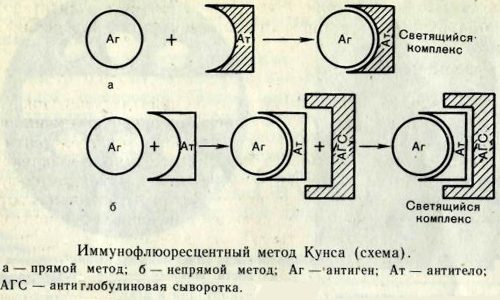
- Реакция иммунофлуоресценции — выявление антигенов вируса в мазках-отпечатках мозговой и железистой ткани.
- Реакция нейтрализации, связывания комплемента, радиоиммунный и иммуноферментный анализы — обнаружение антител против вируса бешенства.
- ПЦР ликвора — определение генетического материала микроба в испытуемом образце.
- Биопроба на лабораторных грызунах – их заражение слюной или ликвором больного.
- Гистологический анализ биопсийного материала – мозговой ткани, взятой от умершего человека.
Диагностические процедуры проводят сертифицированные специалисты в условиях лаборатории особо опасных инфекций. Окончательный диагноз бешенства обычно устанавливается посмертно.
Патогенетические особенности
Патогенные биологические агенты проникают в макроорганизм через рану, образовавшуюся в результате укуса животного. В месте внедрения происходит первичная репликация микробов. Сначала поражаются мягкие ткани вокруг раны, а затем нервные волокна. По ним вирусы направляются в церебральные и спинномозговые структуры. Гематогенный и лимфогенный пути диссеминации возбудителя не играют существенной роли в развитии патологии. Вирусы взаимодействуют с нейромедиаторами, осуществляющими нервно-мышечную передачу, повышая возбудимость нейронов, а затем вызывая их паралич. Этот механизм лежит в основе патогенеза болезни.
Проникая нейрогенным путем в клетки мозговой ткани, вирусы провоцируют развитие грубых и необратимых нарушений в работе ЦНС. У больных возникает негнойный менингоэнцефалит, и происходит постепенное разрушение нервных клеток. На месте погибших нейронов образуются тельца Бабеша-Негри. Патоморфологические особенности бешенства – кровоизлияние в мозг, отек мозговой ткани, очаги некроза, дегенеративные изменения. Органическое поражение приводит к стойкой дисфункции. В организме нарушается иннервация внутренних органов и тканей, и развивается полиорганная недостаточность.
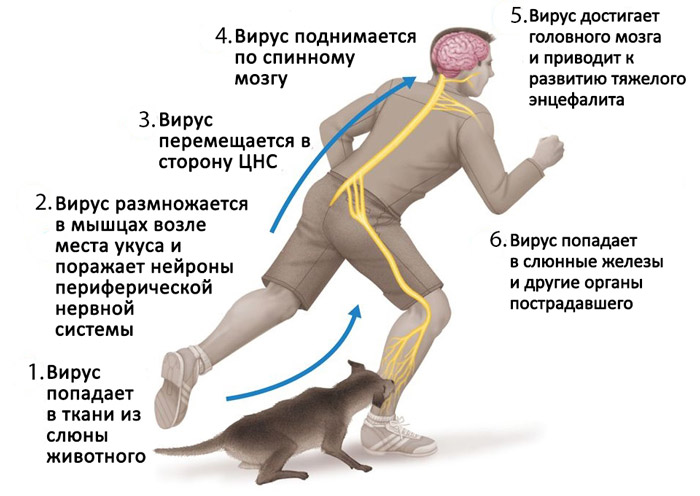
Стремительная деструкция очагов жизнеобеспечения, расположенных в коре головного мозга, клинически проявляется судорожным синдромом, парезами и параличами. Больные впадают в кому и погибают от асфиксии и остановки сердца, которые вызваны поражением соответствующих центров в головном мозге. Смерть наступает очень быстро без предшествующего развития осложнений и наступления негативных последствий.