Инфекции, вызванные acinetobacter
Содержание:
- Description
- 1. Энтеробактерии, в том числе клебсиелла, кишечная палочка, серрации и протеус
- Резистентность P. aeruginosa к АМП
- Antibiotics
- Colistimethate sodium (Coly-Mycin M)
- Meropenem (Merrem)
- Amikacin
- Polymyxin B
- Tigecycline (Tygacil)
- Rifampin (Rifadin)
- Minocycline (Minocin, Solodyn)
- Treatment
- Antibiotic resistance
- Acinetobacter lwoffii лечение
- Treatment
- 11 ответов
- лечение
- Похожие и рекомендуемые вопросы
- Morphology and culture
- Болезни, вызываемые Acinetobacter (АВ)
- Выделение МО
- Категории
- Identification
- Факторы риска и особенности инфекции
Description
Species of the genus Acinetobacter are strictly aerobic, nonfermentative, Gram-negative . They show mostly a coccobacillary morphology on nonselective agar. Rods predominate in fluid media, especially during early growth.
The morphology of Acinetobacter species can be quite variable in Gram-stained human clinical specimens, and cannot be used to differentiate Acinetobacter from other common causes of infection.
Most strains of Acinetobacter, except some of the A. lwoffii strain, grow well on MacConkey agar (without salt). Although officially classified as not lactose-fermenting, they are often partially lactose-fermenting when grown on MacConkey agar. They are oxidase-negative, catalase-positive, indole-negative, nonmotile, and usually nitrate-negative.
Bacteria of the genus Acinetobacter are known to form intracellular inclusions of polyhydroxyalkanoates under certain environmental conditions (e.g. lack of elements such as phosphorus, nitrogen, or oxygen combined with an excessive supply of carbon sources).
1. Энтеробактерии, в том числе клебсиелла, кишечная палочка, серрации и протеус
Устойчивость: к карбапенемам и штаммам, продуцирующим бета-лактамазы расширенного спектра действия
 Как и предыдущие два участника списка опаснейших бактерий современности энтеробактерии относятся к грамотрицательным бактериям, устойчивым ко многим лекарственным препаратам. Они не широко распространены, но вызывают серьезные, часто смертельные инфекции, особенно у людей с ослабленным иммунитетом, например, в результате химиотерапии или трансплантации органов. Наиболее опасные штаммы недавно приобрели устойчивость к классу антибиотиков под названием «карбапенемы». Это были единственные лекарства, которые ранее эффективно убивали энтеробактерии, синегнойную палочку и акинетобактерию Баумана.
Как и предыдущие два участника списка опаснейших бактерий современности энтеробактерии относятся к грамотрицательным бактериям, устойчивым ко многим лекарственным препаратам. Они не широко распространены, но вызывают серьезные, часто смертельные инфекции, особенно у людей с ослабленным иммунитетом, например, в результате химиотерапии или трансплантации органов. Наиболее опасные штаммы недавно приобрели устойчивость к классу антибиотиков под названием «карбапенемы». Это были единственные лекарства, которые ранее эффективно убивали энтеробактерии, синегнойную палочку и акинетобактерию Баумана.
Один патоген, с устойчивостью к антибиотикам, не вошел в подборку ВОЗ. Речь идет о микобактерии туберкулеза
Проблема туберкулеза с лекарственной устойчивостью хорошо известна, а цель рейтинга ВОЗ заключалась в том, чтобы акцентировать внимание на угрозах, которые еще не получили широкого признания. https://www.youtube.com/embed/_156kNezQEk
Резистентность P. aeruginosa к АМП
К основным группам антибиотиков, обладающих клинически значимой антипсевдомонадной активностью, относятся β-лактамы, аминогликозиды и фторхинолоны . Однако P. aeruginosa свойственно наличие множества механизмов выработки устойчивости :
- к аминогликозидам – ферментативная инактивация, снижение проницаемости, модификация мишени действия;
- к β-лактамным АМП – изменение структуры поринового канала (снижение проницаемости), гидролиз β-лактамазами, активный выброс при участии белка OprM, модификация мишени действия ПСБ, изменение структуры поринового белка OprD;
- ко фторхинолонам – изменение структуры мишени действия (ДНК-гиразы), активация системы выведения (MexA-MexB-OprM), снижение проницаемости мембраны.
Особенно важно, что у 30-50% пациентов полирезистентность P. aeruginosa развивается даже при монотерапии
Antibiotics
Empiric antimicrobial therapy should include one of the agents listed below.
Colistimethate sodium (Coly-Mycin M)
View full drug information
Hydrolyzed to colistin, which acts as cationic detergent that can damage bacterial cytoplasmic membrane, causing leaking of intracellular substances and cell death.
Meropenem (Merrem)
View full drug information
Bactericidal broad-spectrum carbapenem antibiotic that inhibits cell wall synthesis. Effective against most gram-positive and gram-negative bacteria. Has slightly increased activity against gram-negative bacteria and slightly decreased activity against staphylococci and streptococci compared with imipenem.
Amikacin
View full drug information
Irreversibly binds to 30S subunit of bacterial ribosomes; blocks recognition step in protein synthesis; causes growth inhibition. For gram-negative bacterial coverage of infections resistant to gentamicin and tobramycin. Effective against P aeruginosa.
Use patient’s IBW for dosage calculation. The same principles of drug monitoring for gentamicin apply to amikacin.
Polymyxin B
View full drug information
Binds to phospholipids, alters permeability, and damages bacterial cytoplasmic membrane.
Tigecycline (Tygacil)
View full drug information
A glycylcycline antibiotic that is structurally similar to tetracycline antibiotics. Inhibits bacterial protein translation by binding to 30S ribosomal subunit and blocks entry of amino-acyl tRNA molecules in ribosome A site. Indicated for complicated skin and skin structure infections caused by E coli, E faecalis (vancomycin-susceptible isolates only), S aureus (methicillin-susceptible and -resistant isolates), S agalactiae, S anginosus group (includes S anginosus, S intermedius, and S constellatus), S pyogenes, and B fragilis.
Rifampin (Rifadin)
View full drug information
Inhibits RNA synthesis in bacteria by binding to beta subunit of DNA-dependent RNA polymerase, which in turn blocks RNA transcription.
Minocycline (Minocin, Solodyn)
View full drug information
Treats infections caused by susceptible gram-negative and gram-positive organisms, in addition to infections caused by susceptible Chlamydia, Rickettsia, and Mycoplasma.
Previous
Treatment
Because most infections are now resistant to multiple drugs, determining what susceptibilities the particular strain has is necessary for treatment to be successful. Traditionally, infections were treated with imipenem or meropenem, but a steady rise in carbapenem-resistant A. baumannii has been noted. Consequently, treatment methods often fall back on polymyxins, particularly colistin. Colistin is considered a drug of last resort because it often causes kidney damage, among other side effects. Prevention methods in hospitals focus on increased hand-washing and more diligent sterilization procedures. An A. baumannii infection was recently treated using phage therapy. Phages are viruses that attack bacteria.
Traumatic injuries, like those from improvised explosive devices, leave large open areas contaminated with debris that are vulnerable to becoming infected with A. baumannii.
The logistics of transporting wounded soldiers result in patients visiting several facilities where they may acquire A. baumannii infections.
Scientists at MIT, Harvard’s Broad Institute and MIT’s CSAIL found a compound named halicin using deep learning that can effectively kill A. baumannii. The compound is a repurposed drug.
Antibiotic resistance
AbaR resistance islands
Pathogenicity islands, relatively common genetic structures in bacterial pathogens, are composed of two or more adjacent genes that increase a pathogen’s virulence. They may contain genes that encode toxins, coagulate blood, or as in this case, allow the bacteria to resist antibiotics. AbaR-type resistance islands are typical of drug-resistant A. baumannii, and different variations may be present in a given strain. Each consists of a transposon backbone of about 16.3 Kb that facilitates horizontal gene transfer. Transposons allow portions of genetic material to be excised from one spot in the genome and integrate into another. This makes horizontal gene transfer of this and similar pathogenicity islands more likely because, when genetic material is taken up by a new bacterium, the transposons allow the pathogenicity island to integrate into the new microorganism’s genome. In this case, it would grant the new microorganism the potential to resist certain antibiotics. AbaRs contain several genes for antibiotic resistance, all flanked by insertion sequences. These genes provide resistance to aminoglycosides, aminocyclitols, tetracycline, and chloramphenicol.
Efflux pumps
are protein machines that use energy to pump antibiotics and other small molecules that get into the bacterial cytoplasm and the periplasmic space out of the cell. By constantly pumping antibiotics out of the cell, bacteria can increase the concentration of a given antibiotic required to kill them or inhibit their growth when the target of the antibiotic is inside the bacterium. A. baumannii is known to have two major efflux pumps which decrease its susceptibility to antimicrobials. The first, AdeB, has been shown to be responsible for aminoglycoside resistance. The second, AdeDE, is responsible for efflux of a wide range of substrates, including tetracycline, chloramphenicol, and various carbapenems.
Small RNA
Bacterial small RNAs are noncoding RNAs that regulate various cellular processes. Three sRNAs, AbsR11, AbsR25, and AbsR28, have been experimentally validated in the MTCC 1425 (ATCC15308) strain, which is a (multidrug-resistant) strain showing resistance to 12 antibiotics. AbsR25 sRNA could play a role in the efflux pump regulation and drug resistance.
Beta-lactamase
A. baumannii has been shown to produce at least one beta-lactamase, which is an enzyme responsible for cleaving the four-atom lactam ring typical of beta-lactam antibiotics. Beta-lactam antibiotics are structurally related to penicillin, which inhibits synthesis of the bacterial cell wall. The cleaving of the lactam ring renders these antibiotics harmless to the bacteria. The beta-lactamase OXA-51 was found to be flanked by insertion sequences, suggesting it was acquired by horizontal gene transfer.
Biofilm formation
A. baumannii has been noted for its apparent ability to survive on artificial surfaces for an extended period of time, therefore allowing it to persist in the hospital environment. This is thought to be due to its ability to form biofilms. For many biofilm-forming bacteria, the process is mediated by flagella. However, for A. baumannii, this process seems to be mediated by pili. Further, disruption of the putative pili chaperone and usher genes csuC and csuE were shown to inhibit biofilm formation. The formation of biofilms has been shown to alter the metabolism of microorganisms within the biofilm, consequently reducing their sensitivity to antibiotics. This may be because fewer nutrients are available deeper within the biofilm. A slower metabolism can prevent the bacteria from taking up an antibiotic or performing a vital function fast enough for particular antibiotics to have an effect. They also provide a physical barrier against larger molecules and may prevent desiccation of the bacteria.
Acinetobacter lwoffii лечение
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии. Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp
из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp
выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно
Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен
Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения. Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Treatment
Acinetobacter species are innately resistant to many classes of antibiotics, including penicillin, chloramphenicol, and often aminoglycosides. Resistance to fluoroquinolones has been reported during therapy, which has also resulted in increased resistance to other drug classes mediated through active drug efflux. A dramatic increase in antibiotic resistance in Acinetobacter strains has been reported by the Centers for Disease Control and Prevention (CDC), and the carbapenems are recognised as the gold-standard and treatment of last resort.Acinetobacter species are unusual in that they are sensitive to sulbactam, which is commonly used to inhibit bacterial beta-lactamase, but this is an example of the antibacterial property of sulbactam itself.
In November 2004, the CDC reported an increasing number of A. baumannii bloodstream infections in patients at military medical facilities in which service members injured in the Iraq/Kuwait region during Operation Iraqi Freedom and in Afghanistan during Operation Enduring Freedom were treated. Most of these were multidrug-resistant. Among one set of isolates from Walter Reed Army Medical Center, 13 (35%) were susceptible to imipenem only, and two (4%) were resistant to all drugs tested. One antimicrobial agent, colistin (polymyxin E), has been used to treat infections with multidrug-resistant A. baumannii; however, antimicrobial susceptibility testing for colistin was not performed on isolates described in this report. Because A. baumannii can survive on dry surfaces up to 20 days, they pose a high risk of spread and contamination in hospitals, potentially putting immunocompromised and other patients at risk for drug-resistant infections that are often fatal and, in general, expensive to treat.
Reports suggest this bacterium is susceptible to phage therapy.
Gene-silencing antisense oligomers in a form called peptide-conjugated phosphorodiamidate morpholino oligomers have also been reported to inhibit growth in tests carried out in animals infected with antibiotic-resistant A. baumannii.
11 ответов
Не забывайте оценивать ответы врачей, помогите нам улучшить их, задавая дополнительные вопросы по теме этого вопроса.Также не забывайте благодарить врачей.
Кириченко Елена Владимировнагастроэнтеролог 2015-12-13 00:02
Карина! Acinetobacter — повсеместно встречающаяся бактерия. У здоровых людей, в частности, он обитает на коже, также выделяется из кишечника. Учитывая название препаратов, которые выдала лаборатория при посеве из зева, ребенка нужно пролечить. Кал нужно сдать на дисбактериоз. Чтобы знать какая микрофлора живет в кишечнике. Линекс помог ребенку справиться с запором по простой причине. Этот препарат содержит лакто и бифидобактерии. Которых не хватало в кишечнике после перенесенных вирусных энтеритов и употребление форлакса. Форлакс нельзя употреблять до возраста 8 лет.
Карина 2015-12-13 16:31
Спасибо за ответ!
Карина 2015-12-22 20:20
Добрый день! Помогите разобраться мне какими препаратами мне пролечить ребёнка, лор врач выписал нам препараты, они подчёркнуты, но один из них противопоказан детям до 18 лет.
цефтазидим- 1 флакон развести 100мл воды и капать в нос + полоскать горло 3 раза в день 10 дней.
левофлоксацин- 125 мг 1 раз в день -7 дней.
так можно детям? Эти препараты точно вылечат бактерии?
буду ждать вашего ответа, заранее спасибо!
Увеличить
Кириченко Елена Владимировнагастроэнтеролог 2015-12-22 20:52
Карина! Левофлоксацин не принимать, т. к. маленький возраст есть противопоказанием для приема детям. Проводите только местное лечение. И ходите на КУФ в носовые ходы в физ. Кабинет.
Карина 2015-12-22 21:25
Спасибо вам огромное!
Карина 2015-12-24 21:27
Добрый день! Подскажите мне расшифровку анализа калла на дисбактериоз, сдала его по вашей рекомендации.
Заранее спасибо.
Увеличить
Кириченко Елена Владимировнагастроэнтеролог 2015-12-24 22:01
Карина! В этом анализе есть незначительное повышение энтеробактерии до 10 в 5 степени. Это повышенное число может вызывать запор. Бактериофаги, на которые провела проверку лаборатория, не снижают количество энтеробактерии. Пропейте курсом 14 дней Нормофлорин -Л. Этот пробиотик усиливает перистальтику кишечника и устраняет запор. Разрешен к приему с 0 возраста. Пройдите курс лечения Нормофлорином. И опять сдайте кал на дисбактериоз.
Карина 2015-12-24 22:14
Большое спасибо Вам!
Вы очень помогли мне)
Екатерина 2017-08-29 12:10
Здравствуйте. Помогите пожалуйста разобраться. Мазки из зева. Что нужно делать и как страшно?
Увеличить
Кириченко Елена Владимировнагастроэнтеролог 2017-08-29 22:33
Екатерина! Фото плохого качества — не видно степени выделенных культур. Лечение можно проводить препаратом Ципрофлоксацин по 250 мг 2 раза в день. Курсом 5 дней. К этому препарату чувствительны все три бактерии. Полоскание раствором Фурацилина -5 дней. Применение таблеток Иммудон. Курс 7 дней. Лечение согласуйте со своим врачом.
Алина 2019-05-06 19:58
Добрый вечер! Acinetobacter junii10*3, str. Mitis/str. Oralis 10*4 у 3х летнего в мазке из зева не патологичен? Чувствительность определена только к меропенему(токсичная группа для детей, чем можно заменить и нужно ли? СРБ завышен до 30
лечение
Антибиотики для лечения инфекций А. Бауманны они чрезвычайно ограничены из-за их большой способности приобретать сопротивления и мультирезистентность
Поэтому важно определить восприимчивость каждого штамма к различным антибиотикам, чтобы обеспечить эффективность каждого лечения.
В связи с устойчивостью к карбапенемам использовалось использование полимиксинов, в частности колистина, несмотря на относительно низкий индекс резистентности и его побочные эффекты на почки..
Однако штаммы, устойчивые к колистину, уже были обнаружены. В качестве альтернативы устойчивости к этим антибиотикам использовалась комбинированная терапия..
Похожие и рекомендуемые вопросы
Хронический запор у ребенка с рождения Ребёнок с рождения с трудом самостоятельно…
Золотистый стафилококк, проблемы со стулом у ребенка Моему сыну 3 месяца 20 дней,…
Биохимия крови ребенка в 1,5 лет Ребенок 3 мес назад перенес рото и норо вирус. Мы…
Запор у ребёнка из-за перегиба жёлчного пузыря Елена Владимировна! Сына, ему 3,5 года…
Зеленый кал у ребенка Дочке полтора года, с момента введения прикорма (в 7 мес.) у…
2 бактерии в горле ребенка 4 лет Klebsiella oxytoca и Acinetobacter junii Резко в…
4 месяца не можем выздороветь, диагноз не ставят, мягкий стул Доброго времени суток!…
Лечение дисбактериоза Подскажите пожалуйста схему лечения дисбактериоза. Прикладываю…
Запор при калькулезном холецистите . Всегда была салонность к запору, с детства. Давно…
Расшифровка анализа копрограммы ребёнка У ребёнка 3-х лет на протяжении 1,5 месяцев…
Дизбактериоз Результат анализа я сфотографировала и Вам отправила, пожалуйста напишите…
Ребенок какает по чуть-чуть У меня ребенок уже 2 месяца какает по чуть-чуть и несколько…
Запоры у ребёнка Моя дочка страдает запорами почти год. В апреле были у гастроэнтеролога…
Инфекционный гастроэнтерит бактериальной(Pseudomonas aeruginosa) излечимо? Подскажите…
Проблема с кишечником, зелёная слизь, чёрные вкрапления, кислый запах Ребёнок на смешённом…
Форлакс при запоре Дочери 4 года, мучаемся запорами 1.5 года. При том скорей всего…
Золотистый стафилококк и плохой аппетит у ребенка У моего ребенка с рождения проблемы…
Запоры, вздутие кишечника Года назад начались боли в основном с утра где то в районе…
В анализе кала на дисбактериоз нашли стафилококки Елена Владимировна! У меня в анализе…
Неперевариваемость пищи Ребенку 3.5 года. Все это время боролись с аллергией сидели…
Morphology and culture
In Acinetobacter baumannii is immobile, aerobic, gram-negative short rods with a size of about 1-1.5 x 1.5-2 microns. Originally belonged to the genus Acinetobacter to the family of Neisseriaceae. Later, she was assigned to the family of Moraxellaceae. Most strains of Acinetobacter baumannii show on solid culture media flat colorless colonies that are slightly smaller than those of Enterobacteriaceae. Some strains are in liquid culture media difficult or impossible to cultivate.
The differentiation in routine laboratories is based on the metabolic activities. However, the precise differentiation of the species with standard methods is often not possible. Therefore, four Genomospezies were summarized for Acinetobacter baumannii Acinetobacter calcoaceticus complex. Acinetobacter species can ferment glucose and thus do not belong to the so-called «non-fermenters.»
Болезни, вызываемые Acinetobacter (АВ)
Инфекции АВ, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Уровень смертности, связанный с инфекцией АВ, составляет 19-54%.
Наиболее часто поражаются органы дыхания. Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать гнойные инфекции в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия. Редко эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), целлюлит или флебит у пациентов с постоянным венозным катетером, глазные инфекции, врожденный или спровоцированный протезом клапана эндокардит, остеомиелит, септический артрит и абсцессы поджелудочной железы и печени.
Значимость выделенных изолятов из клинических образцов определить трудно,потому что они часто представляют собой колонизацию.
Факторы риска. Факторы риска развития инфекции зависят от следующих факторов -это приобретенная в больнице, внебольничная, резистентность ко многим лекарствам.
| Тип инфекции | Факторы риска |
|---|---|
| Приобретенная в больнице |
Колонизация возбудителя АВ в фекалиях с Acinetobacter Пребывание в отделении интенсивной терапии Установка катетера Продолжительность пребывания в больнице Механическая вентиляция Парентеральное питание Предшествующая инфекция Операция Лечение антибиотиками широкого спектра Раны |
| Внебольничная форма |
Алкоголизм Курение Хроническое заболевание легких Сахарный диабет Проживание в тропической развивающейся стране |
| Резистентность ко многим лекарствам |
Контакт с бактерионосителями или зараженными пациентами Инвазивные процедуры Механическая вентиляция, особенно если пролонгированно Длительная госпитализация (особенно в отделении интенсивной терапии) Назначение препаратов крови Использование антибиотиков |
Резистентность к препарату. В настоящее время появились штаммы АВ с резистентностью ко многим лекарствам. Распространение штаммов АВ в отделениях интенсивной терапии было связано с медицинским персоналом, у которых выявлена высокая колонизация данного микроорганизма, а также с зараженным оборудованием общего использования и зараженными растворами для парентерального питания.
Выделение МО
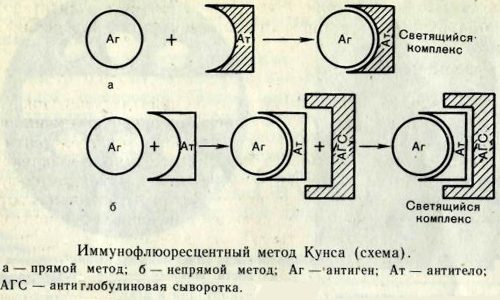
В микробиологическом отношении синегнойная палочка нетребовательна, растет на различных искусственных средах (ЭНДО, Клиглера, Кода, Левина и др.) в обычных условиях, при температуре до 42 оС (оптимально – 37 оС), не ферментирует лактозу и образует гладкие круглые колонии флуоресцирующего зеленоватого цвета со сладковатым запахом. В мазке, приготовленном из чистой культуры, палочки могут располагаться одиночно, парами или образовывать короткие цепочки. Специфическим свойством P. aeruginosa является феномен «радужного лизиса», а также способность интенсивно окрашивать среду (чаще в сине-зеленые цвета). С помощью серологической диагностики в относительно короткие сроки можно выявить как антигены возбудителя инфекции, так и антитела, вырабатываемые в ответ на антигенную стимуляцию иммунной системы .
Имеются родственные с P. aeruginosa МО, такие как S. maltophilia и B. cepacia, с которыми требуется корректная микробиологическая идентификационная дифференциальная диагностика. Это связано с тем, что S. maltophilia обладает природной устойчивостью к карбапенемам, B. cepacia – к аминогликозидам, а P. aeruginosa – природной чувствительностью к ним (хотя резистентность может быть приобретенной) .
Acinetobacter культивируют на обычных средах в диапазоне температур 20-30 оС, с оптимальной температурой роста 33-35 оС; эти МО не нуждаются в факторах роста, не способны к денитрификации. Большинство штаммов растут на минеральных средах, содержащих в качестве единственного источника углерода и энергии этанол, ацетат, пируват, лактат, а в качестве источника азота – соли аммония или нитраты .
Идентификация. В условиях практической лаборатории для идентификации бактерий рода Acinetobacter и дифференциации их от других грамотрицательных МО достаточно использовать минимальный набор тестов. При этом определяющими признаками служат: форма клеток (кокки или мелкие палочки), отсутствие подвижности, характер и способность роста на среде МакКонки (лактозоотрицательные колонии мелких и средних размеров), отсутствие изменений цвета индикатора на полиуглеводном агаре Клиглера и ощелачивание среды, отрицательный цитохромоксидазный тест. Для дифференциации Acinetobacter spp. от других оксидазонегативных неферментирующих бактерий используют дополнительные тесты. Видовая идентификация Acinetobacter значительно сложнее и, как правило, в рутинной практике не проводится .
Категории
АллергологАнестезиолог-реаниматологВенерологГастроэнтерологГематологГенетикГинекологГомеопатДерматологДетский гинекологДетский неврологДетский урологДетский хирургДетский эндокринологДиетологИммунологИнфекционистКардиологКосметологЛогопедЛорМаммологМедицинский юристНаркологНевропатологНейрохирургНефрологНутрициологОнкологОнкоурологОртопед-травматологОфтальмологПедиатрПластический хирургПроктологПсихиатрПсихологПульмонологРевматологРентгенологСексолог-АндрологСтоматологТерапевтТрихологУрологФармацевтФитотерапевтФлебологХирургЭндокринолог
Identification
Identification of Acinetobacter species is complicated by lack of standard identification techniques. Initially, identification was based on phenotypic characteristics such as growth temperature, colony morphology, growth medium, carbon sources, gelatin hydrolysis, glucose fermentation, among others. This method allowed identification of A. calcoaceticus–A. baumannii complex by the formation of smooth, rounded, mucoid colonies at 37 °C. Closely related species could not be differentiated and individual species such as A. baumannii and Acinetobacter genomic species 3 could not be positively identified phenotypically.
Because routine identification in the clinical microbiology laboratory is not yet possible, Acinetobacter isolates are divided and grouped into three main complexes:
- Acinetobacter calcoaceticus-baumannii complex: glucose-oxidising nonhemolytic (A. baumannii can be identified by OXA-51 typing)
- Acinetobacter lwoffii: glucose-negative nonhemolytic
- Acinetobacter haemolyticus: hemolytic
Different species of bacteria in this genus can be identified using fluorescence-lactose-denitrification to find the amount of acid produced by metabolism of glucose. The other reliable identification test at genus level is chromosomal DNA transformation assay. In this assay, a naturally competent tryptophan auxotrophic mutant of Acinetobacter baylyi (BD4 trpE27) is transformed with the total DNA of a putative Acinetobacter isolate and the transformation mixture is plated on a brain heart infusion agar. The growth is then harvested after incubation for 24 h at 30 °C, plating on an Acinetobacter minimal agar (AMA), and incubating at 30 °C for 108 h. Growth on the AMA indicates a positive transformation assay and confirms the isolate as a member of the genus Acinetobacter. E. coli HB101 and A. calcoaceticus MTCC1921T can be used as the negative and positive controls, respectively.
Some of the molecular methods used in species identification are repetitive extragenic palindromic sequence-based PCR, ribotyping, pulsed field gel electrophoresis (PFGE), random amplified polymorphic DNA, amplified fragment length polymorphism (AFLP), restriction and sequence analysis of tRNA and 16S-23S rRNA gene spacers and amplified 16S ribosomal DNA restriction analysis (ARDRA). PFGE, AFLP, and ARDRA are validated common methods in use today because of their discriminative ability. However, most recent methods include multilocus sequence typing and multilocus PCR and electrospray ionization mass spectrometry, which are based on amplification of highly conserved housekeeping genes and can be used to study the genetic relatedness between different isolates.
Факторы риска и особенности инфекции
Вследствие наличия у P. aeruginosa множества факторов вирулентности инфекции, обусловленные этим МО, потенциально более опасны, чем вызванные другими условно-патогенными микроорганизмами .
Источником заражения в первую очередь являются больные с синегнойной инфекцией, а также обслуживающий персонал. Существенным фактором распространения синегнойной инфекции могут служить зараженные предметы обихода, растворы, кремы для рук, полотенца для лица, гениталий, помазок для бритья и т.п. К редко встречающимся факторам следует отнести распространение инфекции через инструменты, приборы и аппаратуру, которые подвергались дезинфекции, оказавшейся неэффективной .
Синегнойная палочка поражает в основном людей с ослабленным иммунитетом: госпитализированных больных с сопутствующими заболеваниями, лиц пожилого возраста и детей . Ряд состояний, таких как муковисцидоз, ожоги, лейкозы, мочекаменная болезнь, нахождение на искусственной вентиляции легких (ИВЛ), являются независимыми предрасполагающими факторами риска . Перечень состояний, предрасполагающих к развитию инфекции, приведен в таблице 2.
Наиболее серьезными из нозокомиальных инфекций считаются ИВЛ-ассоциированные пневмонии. К факторам риска развития таких пневмоний, вызванных P. aeruginosa, относятся предшествующая терапия цефалоспоринами III поколения, длительная госпитализация или обструктивные заболевания легких. Летальность при бактериологически подтвержденной ИВЛ-ассоциированной пневмонии (обсемененность материала, полученного из нижних отделов дыхательных путей с помощью специальных щеток, защищенных от контаминации в верхних дыхательных путях, более 103 КОЕ/мл) составляет 73%, а при колонизации нижних дыхательных путей P. aeruginosa (обсемененность материала менее 103 КОЕ/мл) – 19% .
При любой локализации первичного очага инфекции, обусловленной P. aeruginosa, возможно развитие бактериемии, существенно ухудшающей прогноз заболевания. По данным многоцентрового Европейского исследования SENTRY, частота бактериемий, вызванных P. aeruginosa, составляет 5%. При этом показатели общей летальности составляют 40-75%, атрибутивной – 34-48% .
Роль P. aeruginosa в этиологии внебольничных инфекций невелика .
К возникновению ацинетобактерной колонизации (и впоследствии – инфекции) предрасполагают длительная госпитализация или антимикробная терапия (особенно АМП с низкой активностью к ацинетобактериям), нахождение в отделении других пациентов, колонизированных данным МО, а в условиях ОИТ – использование респираторного или катетерного оборудования инвазивного характера .
Как уже отмечалось выше, Acinetobacter spp. поражают иммуноскомпрометированных пациентов. Чаще всего эти МО вызывают нозокомиальные инфекции. Многие из них имеют относительно вялотекущий характер, однако они чрезвычайно устойчивы к терапии.